题目内容
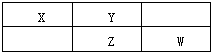 X、Y、Z、W为四种常见的短周期元素.其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如图所示:
X、Y、Z、W为四种常见的短周期元素.其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如图所示:请回答下列问题:
(1)W在周期表中的位置
(2)X和氢可以构成+1价阳离子,其电子式是
(3)X的最高价氧化物的水化物与其氢化物能化合生成M,M的水溶液显酸性的原因是
(4)①Y和Z可组成一种气态化合物Q,Q能与W的单质在潮湿环境中反应,反应的化学方程式是
②在一定条件下,化合物Q与Y的单质反应达平衡时有三种气态物质,反应时,每转移4mol电子放热190.0kJ,该反应的热化学方程式是
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由短周期元素X、Y、Z、W在元素周期表中的位置,可知X、Y处于第二周期,Z、W处于第三周期,Y原子的最外层电子数是其电子层数的3倍,最外层电子数为6,故Y为O元素,可推知X为N元素、Z为S元素、W为Cl,据此解答.
解答:
解:由短周期元素X、Y、Z、W在元素周期表中的位置,可知X、Y处于第二周期,Z、W处于第三周期,Y原子的最外层电子数是其电子层数的3倍,最外层电子数为6,故Y为O元素,可推知X为N元素、Z为S元素、W为Cl,
(1)W为Cl元素,处于周期表中第三周期第VIIA 族,故答案为:第三周期第VIIA 族;
(2)X和氢可以构成+1价阳离子为NH4+,其电子式是 ,故答案为:
,故答案为: ;
;
(3)X的最高价氧化物的水化物与其氢化物能化合生成M为NH4NO3,水溶液中铵根离子水解NH4++H2O?NH3?H2O+H+,破坏水的电离平衡,溶液呈酸性,故答案为:NH4++H2O?NH3?H2O+H+;
(4)①Y和Z可组成一种气态化合物Q为SO2,SO2能与氯气在潮湿环境中反应生成硫酸与HCl,反应的化学方程式是:SO2+Cl2+2H2O=2HCl+H2SO4,故答案为:SO2+Cl2+2H2O=2HCl+H2SO4;
②在一定条件下,化合物Q与Y的单质反应达平衡时有三种气态物质,反应方程式为:2SO2+O2?2SO3,反应时,每转移4mol电子放热190.0kJ,则参加反应二氧化硫为
=2mol,该反应的热化学方程式是:2SO2 (g)+O2(g)?2SO3(g)△H=-190.0 kJ?mol-1,
故答案为:2SO2 (g)+O2(g)?2SO3(g)△H=-190.0 kJ?mol-1.
(1)W为Cl元素,处于周期表中第三周期第VIIA 族,故答案为:第三周期第VIIA 族;
(2)X和氢可以构成+1价阳离子为NH4+,其电子式是
 ,故答案为:
,故答案为: ;
;(3)X的最高价氧化物的水化物与其氢化物能化合生成M为NH4NO3,水溶液中铵根离子水解NH4++H2O?NH3?H2O+H+,破坏水的电离平衡,溶液呈酸性,故答案为:NH4++H2O?NH3?H2O+H+;
(4)①Y和Z可组成一种气态化合物Q为SO2,SO2能与氯气在潮湿环境中反应生成硫酸与HCl,反应的化学方程式是:SO2+Cl2+2H2O=2HCl+H2SO4,故答案为:SO2+Cl2+2H2O=2HCl+H2SO4;
②在一定条件下,化合物Q与Y的单质反应达平衡时有三种气态物质,反应方程式为:2SO2+O2?2SO3,反应时,每转移4mol电子放热190.0kJ,则参加反应二氧化硫为
| 4mol |
| 2 |
故答案为:2SO2 (g)+O2(g)?2SO3(g)△H=-190.0 kJ?mol-1.
点评:本题考查结构性质位置关系应用,侧重对化学用语的考查,推断元素是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (1)①氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的.若电解质溶液为H2SO4,其正极电极反应式:
(1)①氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的.若电解质溶液为H2SO4,其正极电极反应式:
 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示;请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示;请回答: 按图装置进行实验,并回答下列问题:
按图装置进行实验,并回答下列问题: