题目内容
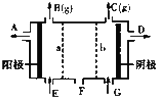 现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽,用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液.下列说法正确的是( )
现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽,用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液.下列说法正确的是( )| A、从A口出来的是H2SO4溶液 |
| B、阳极反应式为2H++2e-═H2↑ |
| C、a是阳离子交换膜,允许H+通过 |
| D、Na2SO4溶液从E口加入 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:据题意,电解饱和Na2SO4溶液时,阳极附近是OH-放电,生成氧气,阴极附近时H+放电生成氢气,由于装置中放置了离子交换膜,在两极分别生成NaOH和H2SO4,需在阳极室一侧放置阴离子交换膜,只允许通过阴离子,在阴极一侧放置阳离子交换膜,只允许通过阳离子;接电源正极的是阳极,即A极放出氧气.
解答:
解:A、连接电源正极的是电解池的阳极,连接电源负极的是电解池的阴极,A为阳极是氢氧根离子放电产生的气体是氧气,同时生成氢离子,则阳极附近生成硫酸,则从A口出来的是H2SO4溶液,故A正确;
B、阳极是氢氧根离子放电,阳极发生的反应为:2H2O-4e-═O2↑+4H+,故B错误;
C、在阳极室一侧放置阴离子交换膜,只允许通过阴离子,故C错误;
D、NaOH在阴极附近生成,则Na2SO4溶液从G口加入,故D错误.
故选A.
B、阳极是氢氧根离子放电,阳极发生的反应为:2H2O-4e-═O2↑+4H+,故B错误;
C、在阳极室一侧放置阴离子交换膜,只允许通过阴离子,故C错误;
D、NaOH在阴极附近生成,则Na2SO4溶液从G口加入,故D错误.
故选A.
点评:本题考查电解池知识,本题设置新情景,即离子交换膜,注意根据两极上的反应判断生成物,题目难度中等.

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
在下列溶液中,各组离子一定能够大量共存的是( )
| A、在NaHCO3溶液中:K+、Na+、SO42-、Al3+ |
| B、由水电离的c(H+)=10-12 mol?L-1的溶液:K+、Cu2+、Cl-、Br- |
| C、在pH=1的溶液中:NH4+、K+、NO3-、Cl- |
| D、有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- |
下列叙述中不正确的是( )
| A、向氯化钙溶液中通入少量CO2,有白色沉淀CaCO3生成 |
| B、向Na2CO3饱和溶液中通入CO2,有NaHCO3结晶析出 |
| C、向NaAlO2溶液中通入过量CO2,有白色胶状沉淀析出 |
| D、等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下生成CO2体积比为53:42 |
下列化学式只能表示一种纯净物的是( )
| A、CF2Cl2 |
| B、C3H6 |
| C、C6H12O6 |
| D、C2H6O |
宁夏的硒砂瓜现今享誉区内外,西瓜富含硒元素,有延年益寿、抗衰老、抗癌作用,因之得名“硒砂瓜”.二氧化硒是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓硝酸或浓硫酸反应生成SeO2以回收Se.在回收过程中涉及如下两个反应①SeO2+4KI+4HNO3═Se+2I2+4KNO3+2H2O ②Se+2H2SO4(浓)═2SO2↑+SeO2+2H2O.下列有关叙述正确的是( )
| A、①中Se是氧化产物,I2是还原产物 |
| B、反应②中浓硫酸体现了氧化性和酸性 |
| C、SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是SeO2>H2SO4(浓)>I2 |
| D、反应①中每有0.6molI2生成,转移电子数目为1.2NA |
标准状况下,某气态有机物密度为3.125g/L,则该有机物的最简式可能是( )
| A、CH |
| B、CH2 |
| C、CH3 |
| D、CH2O |
 (1)①氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的.若电解质溶液为H2SO4,其正极电极反应式:
(1)①氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的.若电解质溶液为H2SO4,其正极电极反应式:
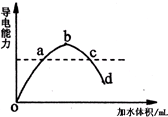 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示;请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示;请回答: