��Ŀ����
 ���ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ����������Ĺؼ����裮��֪��
���ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ����������Ĺؼ����裮��֪��SO2��g��+
| 1 |
| 2 |
��1��ij�¶��¸÷�Ӧ��ƽ�ⳣ��K=
| 10 |
| 3 |
��2��һ���¶��£���һ�����������Ϊ2L���ܱ������г���2.0mol SO2��1.0mol O2���ﵽƽ��������Ϊ1.6L����SO2��ƽ��ת����Ϊ
��3���ڣ�2���еķ�Ӧ�ﵽƽ��ı�������������ʹSO2��g��ƽ��Ũ�ȱ�ԭ����С����
A�������¶Ⱥ�����������䣬����1.0mol O2
B�������¶Ⱥ�������ѹǿ���䣬����1.0mol SO3
C�������¶�
D���ƶ�����ѹ������
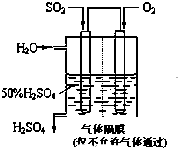
��4������ͼ��ʾװ�ã��õ绯ѧԭ���������ᣬд��ͨ��O2�缫�ĵ缫��ӦʽΪ
���㣺��ѧƽ��ļ���,ԭ��غ͵��صĹ���ԭ��,��ѧƽ���Ӱ������
ר�⣺��ѧƽ��ר��,�绯ѧר��
��������1�����ݼ����Ũ���̺�ƽ�ⳣ���ȽϷ����жϷ�Ӧ���еķ���
��2���ȸ���ƽ�ⳣ�������c��SO2�����ٸ���ת���ʹ�ʽ���SO2��ת���ʣ�
��3������Ũ�ȡ��¶ȡ�ѹǿ����������Ի�ѧƽ���Ӱ�죬���ƽ���ƶ���c��SO2����
��4��ͨ��O2�缫�ĵ缫��������Ӧ�������õ������������������ӣ���������Һ������ˮ������SO2��O2��ˮ�γ�������Һ��Ũ��Ϊ50%�����SO2��ˮ�������ȣ�
��2���ȸ���ƽ�ⳣ�������c��SO2�����ٸ���ת���ʹ�ʽ���SO2��ת���ʣ�
��3������Ũ�ȡ��¶ȡ�ѹǿ����������Ի�ѧƽ���Ӱ�죬���ƽ���ƶ���c��SO2����
��4��ͨ��O2�缫�ĵ缫��������Ӧ�������õ������������������ӣ���������Һ������ˮ������SO2��O2��ˮ�γ�������Һ��Ũ��Ϊ50%�����SO2��ˮ�������ȣ�
���
�⣺��1����ΪŨ����QC=
=
=2.5��K�����Ի�ѧ��Ӧ������У���v��������v���棩��
�ʴ�Ϊ������
��2������Vǰ/V��=nǰ/n�� �ɵã���һ�����������Ϊ2L���ܱ������г���2.0mol SO2��1.0mol O2���ﵽƽ��������Ϊ1.6L��n��=2.4mol
SO2��g��+
O2��g��?SO3��g��
��ʼ��mol�� 2.0 1.0 0
��Ӧ��mol�� a
a a
ƽ�⣨mol�� 2.0-a 1-
a a
��2.0-a��+��1.0-
a��+a=2.4
a=1.2
����SO2��ת���ʦ�=
��100%=60%���ʴ�Ϊ��60%��
��3��A�������¶Ⱥ�����������䣬O2��Ũ������ƽ�������ƶ���SO2��Ũ�ȼ�С������A��ȷ��
B�������¶Ⱥ�������ѹǿ���䣬����0.4mol SO3���µ�ƽ����ԭƽ���Ч��SO2��Ũ�Ȳ��䣬����B����
C�������¶ȣ�ƽ������ȵķ����ƶ���������ӦΪ���ȣ�����ƽ�������ƶ���SO2��Ũ�ȼ�С������C��ȷ��
D���ƶ�����ѹ�����壬SO2��Ũ��˲������֮��ƽ��������������ٵķ����ƶ�����������Ӧ�����ƶ���SO2��Ũ�ȼ�С���ٴε���ƽ��ʱSO2��Ũ���Ա�ԭ��������D����
�ʴ�Ϊ��A��C��
��4��ͨ��O2�缫�ĵ缫��������Ӧ�������õ������������������ӣ���������Һ������ˮ���缫��ӦΪ��O2+4e-+4 H+=2H2O��
�裺SO2��ˮ�������ֱ�Ϊa��b
SO2 +H2O?H2SO3
64 18 82
a
2H2SO3 +O2�T2H2SO4
164 196
��������Һ�������ٷ���Ϊ
��100%=50%��
����a��b=16��29��
�ʴ�Ϊ��O2+4e-+4 H+=2H2O��16��29��
| c(SO3) | ||
c(SO2)c
|
| ||||||
|
�ʴ�Ϊ������
��2������Vǰ/V��=nǰ/n�� �ɵã���һ�����������Ϊ2L���ܱ������г���2.0mol SO2��1.0mol O2���ﵽƽ��������Ϊ1.6L��n��=2.4mol
SO2��g��+
| 1 |
| 2 |
��ʼ��mol�� 2.0 1.0 0
��Ӧ��mol�� a
| 1 |
| 2 |
ƽ�⣨mol�� 2.0-a 1-
| 1 |
| 2 |
��2.0-a��+��1.0-
| 1 |
| 2 |
a=1.2
����SO2��ת���ʦ�=
| 1.2mol |
| 2mol |
��3��A�������¶Ⱥ�����������䣬O2��Ũ������ƽ�������ƶ���SO2��Ũ�ȼ�С������A��ȷ��
B�������¶Ⱥ�������ѹǿ���䣬����0.4mol SO3���µ�ƽ����ԭƽ���Ч��SO2��Ũ�Ȳ��䣬����B����
C�������¶ȣ�ƽ������ȵķ����ƶ���������ӦΪ���ȣ�����ƽ�������ƶ���SO2��Ũ�ȼ�С������C��ȷ��
D���ƶ�����ѹ�����壬SO2��Ũ��˲������֮��ƽ��������������ٵķ����ƶ�����������Ӧ�����ƶ���SO2��Ũ�ȼ�С���ٴε���ƽ��ʱSO2��Ũ���Ա�ԭ��������D����
�ʴ�Ϊ��A��C��
��4��ͨ��O2�缫�ĵ缫��������Ӧ�������õ������������������ӣ���������Һ������ˮ���缫��ӦΪ��O2+4e-+4 H+=2H2O��
�裺SO2��ˮ�������ֱ�Ϊa��b
SO2 +H2O?H2SO3
64 18 82
a
| 18a |
| 64 |
| 82a |
| 64 |
2H2SO3 +O2�T2H2SO4
164 196
| 82a |
| 64 |
| 98a |
| 64 |
��������Һ�������ٷ���Ϊ
| ||||
|
����a��b=16��29��
�ʴ�Ϊ��O2+4e-+4 H+=2H2O��16��29��
���������⿼���˻�ѧƽ����й�֪ʶ��������Ũ�����жϻ�ѧ��Ӧ���еķ���ת���ʵļ��㡢��������Ի�ѧƽ���Ӱ���Լ��йػ�ѧ���㣬��������ۺ���ǿ����Ŀ�ѶȽϴ�

��ϰ��ϵ�д�
 ���ƽ̸�������ѡ����ĩ���100��ϵ�д�
���ƽ̸�������ѡ����ĩ���100��ϵ�д�
�����Ŀ
���ĵ���ɰ���ֽ����������⣬���ϸ�����Ԫ�أ����������١���˥�ϡ��������ã���֮��������ɰ�ϡ�������������һ�����������䱻��ԭ��ĵ��������ܳ�Ϊ������Ⱦ�ͨ����Ũ�����Ũ���ᷴӦ����SeO2�Ի���Se���ڻ��չ������漰����������Ӧ��SeO2+4KI+4HNO3�TSe+2I2+4KNO3+2H2O ��Se+2H2SO4��Ũ���T2SO2��+SeO2+2H2O�������й�������ȷ���ǣ�������
| A������Se���������I2�ǻ�ԭ���� |
| B����Ӧ����Ũ���������������Ժ����� |
| C��SeO2��H2SO4��Ũ����I2����������ǿ������˳����SeO2��H2SO4��Ũ����I2 |
| D����Ӧ����ÿ��0.6molI2���ɣ�ת�Ƶ�����ĿΪ1.2NA |
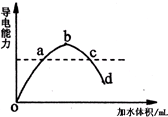 ��һ���¶��£��������ˮϡ�����У���Һ�ĵ���������ͼ��ʾ����ش�
��һ���¶��£��������ˮϡ�����У���Һ�ĵ���������ͼ��ʾ����ش�