题目内容
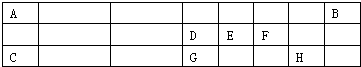
 A、B、C、D是原子序数依次增大的短周期主族元素,A、C在元素周期表中的相对位置如图,A元素最外层与次外层上的电子数之差为3,B为地壳中含最最多的金属元素.
A、B、C、D是原子序数依次增大的短周期主族元素,A、C在元素周期表中的相对位置如图,A元素最外层与次外层上的电子数之差为3,B为地壳中含最最多的金属元素.(1)D原子结构示意图为
(2)将C的低价态氧化物甲通入到D单质的水溶液会使之褪色,体现了甲的
(3)A的最高价氧化物对应的水化物是乙,现将过量Cu加入到100mL 8.0mol/L乙的浓溶液中,充分反应,共收集到6.72L(标准状况)气体,则该气体的成分是
(4)将两份足量的B单质分别加入到等体积等浓度的盐酸和NaOH溶液中,充分反应生成气体的体积比为
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D是原子序数依次增大的短周期主族元素,B为地壳中含最最多的金属元素,则B为Al,C的原子序数大于Al,故C处于第三周期、A处于第二周期,A元素最外层与次外层上的电子数之差为3,最外层电子数为5,故A为N元素、C为S元素、D为Cl元素,据此解答.
解答:
解:A、B、C、D是原子序数依次增大的短周期主族元素,B为地壳中含最最多的金属元素,则B为Al,C的原子序数大于Al,故C处于第三周期、A处于第二周期,A元素最外层与次外层上的电子数之差为3,最外层电子数为5,故A为N元素、C为S元素、D为Cl元素,
(1)D为Cl元素,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)二氧化硫通入氯水中,氯气将二氧化硫氧化为硫酸,自身被还原为HCl,二氧化硫表现还原性,反应离子方程式为:SO2+Cl2+2H2O=4H++2Cl-+SO42-,
故答案为:还原;SO2+Cl2+2H2O=4H++2Cl-+SO42-;
(3)将过量Cu加入到100mL 8.0mol/L硝酸的浓溶液中,充分反应,共收集到6.72L(标准状况)气体,
气体的物质的量=
=0.3mol,根据N原子守恒反应生成硝酸铜的物质的量=
=0.25mol,还原剂Cu失去电子物质的量=0.25mol×2=0.5mol,令N元素在气体中的化合价为n,根据电子转移守恒可知:0.3mol×(5-n)=0.5mol,解得n=
,故生成气体为NO、NO2,还原剂失电子数为0.5NA,
故答案为:NO、NO2;0.5NA;
(4)HCl与NaOH的物质的量相等,由方程式:2Al+6HCl═2AlCl3+3H2↑;2Al+2NaOH+2H2O═2NaAlO2+3H2↑,可知生成氢气体积之比=0.5:1.5=1:3;若将反应后所得的溶液混合,会生成白色沉淀,发生反应的离子方程式为:Al3++3AlO2-+6H2O═4Al(OH)3↓;Al单质表面的氧化膜为氧化铝,可用NaOH溶液除去,该反应的化学方程式为:Al2O3+2NaOH═2NaAlO2+H2O,
故答案为:1:3;Al3++3AlO2-+6H2O═4Al(OH)3↓;Al2O3+2NaOH═2NaAlO2+H2O.
(1)D为Cl元素,原子结构示意图为
 ,故答案为:
,故答案为: ;
;(2)二氧化硫通入氯水中,氯气将二氧化硫氧化为硫酸,自身被还原为HCl,二氧化硫表现还原性,反应离子方程式为:SO2+Cl2+2H2O=4H++2Cl-+SO42-,
故答案为:还原;SO2+Cl2+2H2O=4H++2Cl-+SO42-;
(3)将过量Cu加入到100mL 8.0mol/L硝酸的浓溶液中,充分反应,共收集到6.72L(标准状况)气体,
气体的物质的量=
| 6.72L |
| 22.4L/mol |
| 0.1L×8mol/L-0.3mol |
| 2 |
| 10 |
| 3 |
故答案为:NO、NO2;0.5NA;
(4)HCl与NaOH的物质的量相等,由方程式:2Al+6HCl═2AlCl3+3H2↑;2Al+2NaOH+2H2O═2NaAlO2+3H2↑,可知生成氢气体积之比=0.5:1.5=1:3;若将反应后所得的溶液混合,会生成白色沉淀,发生反应的离子方程式为:Al3++3AlO2-+6H2O═4Al(OH)3↓;Al单质表面的氧化膜为氧化铝,可用NaOH溶液除去,该反应的化学方程式为:Al2O3+2NaOH═2NaAlO2+H2O,
故答案为:1:3;Al3++3AlO2-+6H2O═4Al(OH)3↓;Al2O3+2NaOH═2NaAlO2+H2O.
点评:本题考查结构性质位置关系应用,侧重考查化学用语、化学计算,(3)中注意利用守恒思想与平均化合价降低,难度中等.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
化学与科学、技术、社会、环境密切相关.下列有关说法中正确的是( )
| A、明矾[KAl(SO4)2?12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 |
| B、变质的植物油有难闻的特殊气味,是由于植物油发生了酯化反应 |
| C、浸泡过高锰酸钾溶液的硅藻土放于新鲜的水果箱内是为了催熟水果 |
| D、海水淡化可以解决淡水危机,向海水中加入明矾可以使海水淡化 |
在试管中注入某红色溶液,给试管加热,溶液颜色逐渐变浅,则原溶液可能是( )
| A、滴有酚酞的Na2CO3溶液 |
| B、溶有SO2的品红溶液 |
| C、滴有石蕊的AlCl3溶液 |
| D、滴有酚酞的饱和Ca(OH)2溶液 |
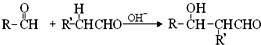 (-R、-R’表示氢原子或烃基)
(-R、-R’表示氢原子或烃基)
 有一种同分异构体G,G能与Na2CO3反应放出CO2,且分子的核磁共振氢谱只有两个吸收峰,G的结构简式为
有一种同分异构体G,G能与Na2CO3反应放出CO2,且分子的核磁共振氢谱只有两个吸收峰,G的结构简式为