题目内容
常温下,将a mL 三种一元酸分别和NaOH溶液等体积混合,实验数据如下:
(1)丙组实验发生反应的离子方程式为 ,所得溶液中由水电离出的c(OH-)= mol/L;
比较此时HX、HY、HZ三种酸的酸性强弱 > > .
(2)部分实验反应过程中的pH变化曲线如图:
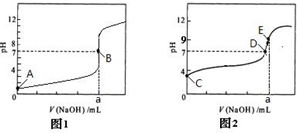
①表示乙组实验的pH变化曲线是 (填图1或图2)
②上图中表示溶液呈中性的点为 ,表示溶液恰好完全反应的点是 .
| 组别 | c(一元酸) | c(NaOH)/mol/L | 混合溶液的pH |
| 甲 | c(HX)=0.1mol/L | 0.1 | pH=10 |
| 乙 | c(HY)=0.1mol/L | 0.1 | pH=7 |
| 丙 | c(HZ)=0.1mol/L | 0.1 | pH=9 |
比较此时HX、HY、HZ三种酸的酸性强弱
(2)部分实验反应过程中的pH变化曲线如图:

①表示乙组实验的pH变化曲线是
②上图中表示溶液呈中性的点为
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:(1)等体积、等浓度的氢氧化钠与HZ反应生成强碱弱酸盐NaZ,Z-离子部分水解,溶液显示碱性,NaZ溶液中的氢氧根离子为水电离的;同浓度的强碱弱酸盐,PH越大酸根离子对应的酸越弱;
(2)①0.1mol/L的酸溶液,图1表示的PH=1说明为强酸,图2起始溶液PH=3,说明为弱酸在溶液中部分电离出氢离子;
②图象中溶液PH=7时溶液呈中性,BD点时溶液显示中性,分析图①,图②可知图1是强酸强碱反应,反应终点时溶液PH=7,图2是弱酸和强碱反应,恰好反应生成的盐是强碱弱酸盐,溶液呈碱性.
(2)①0.1mol/L的酸溶液,图1表示的PH=1说明为强酸,图2起始溶液PH=3,说明为弱酸在溶液中部分电离出氢离子;
②图象中溶液PH=7时溶液呈中性,BD点时溶液显示中性,分析图①,图②可知图1是强酸强碱反应,反应终点时溶液PH=7,图2是弱酸和强碱反应,恰好反应生成的盐是强碱弱酸盐,溶液呈碱性.
解答:
解:(1)NaZ为强碱弱酸盐,Z-离子部分水解,溶液显示碱性,其水解的离子方程式为:Z-+H2O?HZ+OH-;NaZ溶液中的氢氧根离子为水电离的,所以水电离的氢氧根离子浓度为:c(OH-)=1×10-5mol/L,混合溶液的PH的大小顺序为:甲>丙>乙,所以对应的酸的酸性强弱为HY>HZ>HX,故答案为:Z-+H2O?HZ+OH-;1×10-5;
HY>HZ>HX;
(2)①0.1mol/L的酸溶液,图1表示的PH=1说明为强酸,图2起始溶液PH=3,说明为弱酸在溶液中部分电离出氢离子,乙组酸碱等浓度等体积反应溶液PH=7说明溶液呈中性是强酸强碱发生的反应,图1符合,
故答案为:图1;
②图象中溶液PH=7时溶液呈中性,BD点时溶液显示中性,分析图①,图②可知图1是强酸强碱反应,反应终点时溶液PH=7,图2是弱酸和强碱反应,恰好反应生成的盐是强碱弱酸盐,溶液呈碱性,说明BE点是表示溶液恰好完全反应的点,
故答案为:BD;BE.
HY>HZ>HX;
(2)①0.1mol/L的酸溶液,图1表示的PH=1说明为强酸,图2起始溶液PH=3,说明为弱酸在溶液中部分电离出氢离子,乙组酸碱等浓度等体积反应溶液PH=7说明溶液呈中性是强酸强碱发生的反应,图1符合,
故答案为:图1;
②图象中溶液PH=7时溶液呈中性,BD点时溶液显示中性,分析图①,图②可知图1是强酸强碱反应,反应终点时溶液PH=7,图2是弱酸和强碱反应,恰好反应生成的盐是强碱弱酸盐,溶液呈碱性,说明BE点是表示溶液恰好完全反应的点,
故答案为:BD;BE.
点评:本题考查酸碱混合后溶液的定性判断,注意表格中pH的应用是解答本题的关键,明确酸性的强弱及盐类水解的关系即可解答,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
相对分子质量为100的烃,且含有4个甲基的同分异构体共有(不考虑立体异构)( )
| A、3种 | B、4种 | C、5种 | D、6种 |
难溶化合物的溶解能力可以用溶度积Ksp来表示,当溶液中相应离子浓度的乘积大于该值时,会形成沉淀.已知常温下AgCl的Ksp=1.8×10-10,AgI的Ksp=8.5×10-17.若在常温下,向5mL含有KCl和KI各为0.01mol/L的溶液中加入8mL 0.01mol/L AgNO3溶液,此时溶液中所含溶质的离子浓度大小关系正确的是( )
| A、c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) |
| B、c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| C、c(NO3-)>c(K+)>c(Ag+)>c(Cl-)>c(I-) |
| D、c(K+)>c(NO3-)>c(Ag+)=c(Cl-)+c(I-) |
 A、B、C、D是原子序数依次增大的短周期主族元素,A、C在元素周期表中的相对位置如图,A元素最外层与次外层上的电子数之差为3,B为地壳中含最最多的金属元素.
A、B、C、D是原子序数依次增大的短周期主族元素,A、C在元素周期表中的相对位置如图,A元素最外层与次外层上的电子数之差为3,B为地壳中含最最多的金属元素.