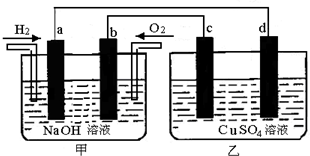
题目内容
标准状况下的HCl气体4.48L溶于水形成100ml溶液,然后与足量的铁屑充分反应.计算:
(1)生成H2的体积;
(2)将生成的FeCl2配成400ml溶液后,从中取出10ml溶液,则取出的溶液中FeCl2的物质的量浓度是多少?
(1)生成H2的体积;
(2)将生成的FeCl2配成400ml溶液后,从中取出10ml溶液,则取出的溶液中FeCl2的物质的量浓度是多少?
考点:化学方程式的有关计算
专题:计算题
分析:根据n=
计算HCl的物质的量,再根据方程式计算氢气的物质的量、FeCl2的物质的量,根据V=nVm计算氢气的体积,根据c=
计算溶液的浓度,溶液是均匀的,取出10ml溶液浓度与原溶液浓度相等.
| V |
| Vm |
| n |
| V |
解答:
解:标况下,4.48L HCl的物质的量=
=0.2mol,则:
Fe+2 HCl=FeCl2+H2↑
2 1 1
0.2mol x y
x=y=
=0.1mol
(1)标况下,生成氢气的体积为0.1mol×22.4L/mol=2.24L,
答:标况下,生成氢气的体积为2.24L.
(2)生成的FeCl2配成400ml溶液,其物质的量浓度=
=0.25mol/L,溶液是均匀的,取出10ml溶液浓度与原溶液浓度相等,即取出10ml溶液浓度为0.25mol/L,
答:取出的10mL溶液中FeCl2的物质的量浓度是0.25mol/L.
| 4.48L |
| 22.4L/mol |
Fe+2 HCl=FeCl2+H2↑
2 1 1
0.2mol x y
x=y=
| 0.2mol×1 |
| 2 |
(1)标况下,生成氢气的体积为0.1mol×22.4L/mol=2.24L,
答:标况下,生成氢气的体积为2.24L.
(2)生成的FeCl2配成400ml溶液,其物质的量浓度=
| 0.1mol |
| 0.4L |
答:取出的10mL溶液中FeCl2的物质的量浓度是0.25mol/L.
点评:本题考查化学方程式的计算,比较基础,注意对基础知识的理解掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列溶液中微粒浓度关系一定正确的是( )
| A、氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+) |
| B、pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)═c(H+) |
| C、0.1 mol?L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
| D、0.1 mol?L-1的硫化钠溶液中:c(OH-)=c(H+)>c(HS-)>c(H2S) |
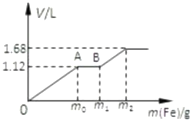 向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.
向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.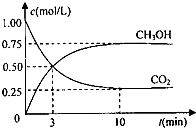 为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.
为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.