题目内容
如图所示,a、b、c、d为惰性电极.甲装置中a、b两个电极上分别通入H2、O2,电解质溶液为NaOH溶液,乙装置中电解质溶液为CuSO4溶液,按要求回答下列各题.
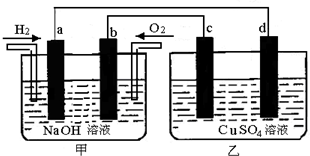
(1)甲装置乙装置分别为 、 (填电解池或原电池).
(2)a电极的电极反应式为 ,c电极的电极反应式为 .
(3)当b电极上通入112mL(标况下)O2时,d电极上析出固体的质量为 g.

(1)甲装置乙装置分别为
(2)a电极的电极反应式为
(3)当b电极上通入112mL(标况下)O2时,d电极上析出固体的质量为
考点:原电池和电解池的工作原理
专题:电化学专题
分析:甲池中a通入氢气,b通入氧气,电解质为KOH溶液,可形成碱性氢氧燃料电池,负极上氢气失电子和氢氧根离子反应生成水,电极反应式为:2H2+4OH--4e-═4H2O,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e-═4OH-,乙为电解池,c为阳极,发生氧化反应,电极方程式为4OH--4e-=2H2O+O2↑,d为阴极,发生还原反应,电极方程式为Cu2++2e-=Cu,以此解答.
解答:
解:a通入氢气,a为负极,b通入氧气,b为正极,电解质为KOH溶液,可形成碱性氢氧燃料电池,负极上氢气失电子和氢氧根离子反应生成水,电极反应式为:2H2+4OH--4e-═4H2O,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e-═4OH-,乙为电解池,c为阳极,发生氧化反应,电极方程式为4OH--4e-=2H2O+O2↑,d为阴极,发生还原反应,电极方程式为Cu2++2e-=Cu,
(1)甲装置为原电池,乙装置为电解池,
故答案为:原电池;电解池;
(2)a通入氢气,a为负极,负极上氢气失电子和氢氧根离子反应生成水,电极反应式为:2H2+4OH--4e-═4H2O,c为阳极,发生氧化反应,电极方程式为4OH--4e-=2H2O+O2↑,
故答案为:2H2+4OH--4e-═4H2O;4OH--4e-=2H2O+O2↑;
(3)b电极上通入112mL O2(标况)时,n(O2)=0.005mol,转移电子为0.005mol×4=0.02mol,d上的电极方程式为Cu2++2e-=Cu,则转移0.02mol电子时生成0.01molCu,所以d电极上析出Cu的质量为0.64g;
故答案为:0.64.
(1)甲装置为原电池,乙装置为电解池,
故答案为:原电池;电解池;
(2)a通入氢气,a为负极,负极上氢气失电子和氢氧根离子反应生成水,电极反应式为:2H2+4OH--4e-═4H2O,c为阳极,发生氧化反应,电极方程式为4OH--4e-=2H2O+O2↑,
故答案为:2H2+4OH--4e-═4H2O;4OH--4e-=2H2O+O2↑;
(3)b电极上通入112mL O2(标况)时,n(O2)=0.005mol,转移电子为0.005mol×4=0.02mol,d上的电极方程式为Cu2++2e-=Cu,则转移0.02mol电子时生成0.01molCu,所以d电极上析出Cu的质量为0.64g;
故答案为:0.64.
点评:本题综合考查原电池和电解池知识,侧重于学生的分析能力和计算能力的考查,为高考常见题型,注意把握电极方程式的书写,为解答该题的关键,难度中等.

练习册系列答案
相关题目
 实际上电离平衡、盐的水解平衡等,它们都可看作是化学平衡的一种.请根据所学化学知识回答下列问题:
实际上电离平衡、盐的水解平衡等,它们都可看作是化学平衡的一种.请根据所学化学知识回答下列问题:
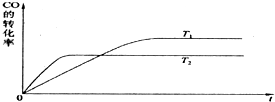
 欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫.请运用化学反应原理的相关知识研究碳及其化合物的性质.
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫.请运用化学反应原理的相关知识研究碳及其化合物的性质.