题目内容
已知可逆反应CO(g)+H2O(g)?CO2(g)+H2(g),
(1)写出该反应的化学平衡常数表达式:K= .
(2)830K时,若起始时:C(CO)=2mol/L,C(H2O)=3mol/L,平衡时CO的转化率为60%,水蒸气的转化率为 ;K值为 .
(3)830K时,若只将起始时C(H2O)改为6mol/L,则水蒸气的转化率为 .
(4)若830K时,起始浓度 C(CO)=a mol/L,C(H2O)=b mol/L,H2的平衡浓度为C(H2)=c mol/L,则:
①a、b、c之间的关系式是 ;②当a=b时,a= c.
(1)写出该反应的化学平衡常数表达式:K=
(2)830K时,若起始时:C(CO)=2mol/L,C(H2O)=3mol/L,平衡时CO的转化率为60%,水蒸气的转化率为
(3)830K时,若只将起始时C(H2O)改为6mol/L,则水蒸气的转化率为
(4)若830K时,起始浓度 C(CO)=a mol/L,C(H2O)=b mol/L,H2的平衡浓度为C(H2)=c mol/L,则:
①a、b、c之间的关系式是
考点:化学平衡的计算,等效平衡
专题:化学平衡专题
分析:(1)依据化学方程式和平衡常数概念书写,利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到;
(2)根据三段式解题法,求出反应混合物各组分浓度的变化量、平衡时各组分的浓度,代入平衡常数表达式计算平衡常数;水蒸气转化率=
×100%;
(3)温度不变,化学平衡常数不变,根据化学平衡常数求出反应掉的水蒸气的物质的量浓度,再根据转化率公式计算水蒸气的转化率;
(4)温度不变,化学平衡常数不变,利用三段式法结合平衡常数计算a、b、c之间的关系式.
(2)根据三段式解题法,求出反应混合物各组分浓度的变化量、平衡时各组分的浓度,代入平衡常数表达式计算平衡常数;水蒸气转化率=
| 消耗量 |
| 起始量 |
(3)温度不变,化学平衡常数不变,根据化学平衡常数求出反应掉的水蒸气的物质的量浓度,再根据转化率公式计算水蒸气的转化率;
(4)温度不变,化学平衡常数不变,利用三段式法结合平衡常数计算a、b、c之间的关系式.
解答:
解:(1)依据化学方程式,CO(g)+H2O(g)?CO2(g)+H2(g),结合平衡常数概念是利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到
K=
,故答案为:
;
(2)平衡时CO的转化率为60%,则CO的浓度变化量=2mol/L×60%=1.2mol/L,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始(mol/L):2 3 0 0
变化(mol/L):1.2 1.2 1.2 1.2
平衡(mol/L):0.8 1.8 1.2 1.2
故平衡常数K=
=1,
水蒸气的转化率=
=40%;
故答案为:40%;1;
(3)设反应的水蒸气的浓度变化量为xmol/L,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始(mol/L):2 3 0 0
变化(mol/L):x x x x
平衡(mol/L):2-x 6-x x x
故
=1,解得y=1.5,
所以水蒸气的转化率为
=25%,
故答案为:25%;
(3)CO(g)+H2O(g)?CO2(g)+H2(g)
起始(mol/L):a b 0 0
变化(mol/L):c c c c
平衡(mol/L):a-c b-c c c
故
=1,整理得ab=ac+bc;当a=b,a=2c;
故答案为:ab=ac+bc,a=2c.
K=
| c(CO2)c(H2) |
| c(CO)c(H2O) |
| c(CO2)c(H2) |
| c(CO)c(H2O) |
(2)平衡时CO的转化率为60%,则CO的浓度变化量=2mol/L×60%=1.2mol/L,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始(mol/L):2 3 0 0
变化(mol/L):1.2 1.2 1.2 1.2
平衡(mol/L):0.8 1.8 1.2 1.2
故平衡常数K=
| 1.2×1.2 |
| 0.8×1.8 |
水蒸气的转化率=
| 1.2mol |
| 3mol/L |
故答案为:40%;1;
(3)设反应的水蒸气的浓度变化量为xmol/L,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始(mol/L):2 3 0 0
变化(mol/L):x x x x
平衡(mol/L):2-x 6-x x x
故
| x2 |
| (2-x)(6-x) |
所以水蒸气的转化率为
| 1.5mol |
| 6mol/L |
故答案为:25%;
(3)CO(g)+H2O(g)?CO2(g)+H2(g)
起始(mol/L):a b 0 0
变化(mol/L):c c c c
平衡(mol/L):a-c b-c c c
故
| c2 |
| (a-c)(b-c) |
故答案为:ab=ac+bc,a=2c.
点评:本题考查了用三段式法对化学反应进行计算,难度中等,注意化学平衡常数K只与温度有关,与其他物理量无关,注意化学平衡常数的应用.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
已知反应:3A(g)+4B(g)?C(g)+2D(g)其反应速率可以分别用vA、vB、vC、vD 表示,下列关系式正确的是( )
A、vA=
| ||
B、vB=
| ||
| C、vC=4vB | ||
D、vD=
|
下列各组内两种物质在溶液中的反应,可用同一离子方程式表示的是( )
| A、氢氧化钠与硝酸;氢氧化钾与盐酸 |
| B、碳酸钠与硝酸;碳酸氢钠与盐酸 |
| C、硫酸与氢氧化钡;硫酸雨氯化钡 |
| D、硫酸铜与氢氧化钡;氯化铜与氢氧化钡 |

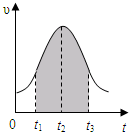 实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(L?s)]与反应时间t(s)的关系如图所示.该反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(L?s)]与反应时间t(s)的关系如图所示.该反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O