题目内容
下列说法正确的是( )
| A、100mL1mol/L Al2(SO4)3溶液中,Al3+数为0.2×6.02×1023 |
| B、0.1mol锌与100mL1mol/L 的稀盐酸充分反应,产生氢气的分子数为0.1×6.02×1023 |
| C、C60和C70的混合物共12g,其中所含碳原子数为6.02×1023 |
| D、1mol甲基(-CH3)与1mol氢氧根(OH-)所含电子数均为10×6.02×1023 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.Al3+能发生水解;
B.盐酸不足量,以盐酸的量为准进行计算;
C.碳原子的总质量为12g;
D.1个甲基(-CH3)含有9个电子.
B.盐酸不足量,以盐酸的量为准进行计算;
C.碳原子的总质量为12g;
D.1个甲基(-CH3)含有9个电子.
解答:
解:A.Al3+能发生水解,离子数小于0.2×6.02×1023,故A错误;
B.盐酸不足量,以盐酸的量为准进行计算生成的,生成氢气0.05mol,氢气的分子数为0.05×6.02×1023,故B错误;
C.碳原子的总质量为12g,物质的量是1mol,所含碳原子数为6.02×1023,故C正确;
D.1个甲基(-CH3)含有9个电子,1mol甲基(-CH3)所含的电子数为9NA,故D错误.
故选C.
B.盐酸不足量,以盐酸的量为准进行计算生成的,生成氢气0.05mol,氢气的分子数为0.05×6.02×1023,故B错误;
C.碳原子的总质量为12g,物质的量是1mol,所含碳原子数为6.02×1023,故C正确;
D.1个甲基(-CH3)含有9个电子,1mol甲基(-CH3)所含的电子数为9NA,故D错误.
故选C.
点评:本题考查了阿伏加德罗常数的有关计算和应用,难度不大,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,注意物质的构成和性质.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
已知某元素原子的各级电离能( kJ?mol-1)数值如下表,则该原子最外层的电子数为( )
| I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| 577 | 1820 | 2740 | 11600 | 14800 | 18400 | 23400 |
| A、1 | B、3 | C、5 | D、7 |
如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是( )
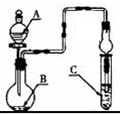

| A、若A为浓硫酸,B为铜,C中盛品红溶液,则C中溶液褪色 |
| B、若A为醋酸,B为贝壳,C中盛CaCl2溶液,则C中溶液变浑浊 |
| C、若A为浓盐酸,B为MnO2,C中盛KI-淀粉溶液,则C中溶液变蓝 |
| D、若A为水,B为Na2O2固体,C中盛氢硫酸溶液,则C中溶液变浑浊 |
已知某元素+3价离子的电子排布为:1s22s22p63s23p63d5,该元素在周期表中的位置正确的是( )
| A、第三周期Ⅷ族,p区 |
| B、第三周期ⅤB族,ds区 |
| C、第四周期Ⅷ族,d区 |
| D、第四周期ⅤB族,f区 |
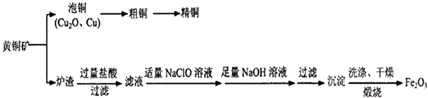
 可以由下列反应合成三聚氰胺:CaO+3C
可以由下列反应合成三聚氰胺:CaO+3C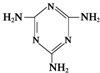 俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸
俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸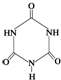 后,三聚氰酸与三聚氰胺分子相互之间通过
后,三聚氰酸与三聚氰胺分子相互之间通过