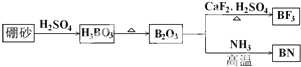
题目内容
已知某元素原子的各级电离能( kJ?mol-1)数值如下表,则该原子最外层的电子数为( )
| I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| 577 | 1820 | 2740 | 11600 | 14800 | 18400 | 23400 |
| A、1 | B、3 | C、5 | D、7 |
考点:元素电离能、电负性的含义及应用
专题:元素周期律与元素周期表专题
分析:分析该元素的电离能可知,第四电离能剧增,说明该元素容易失去3个电子,则该元素原子最外层电子数为3个.
解答:
解:分析该元素的电离能可知,第四电离能剧增,第一二三电离能较小,说明该元素容易失去3个电子,则该元素原子最外层电子数为3个.
故选B.
故选B.
点评:本题考查了电离能,根据电离能的变化推测最外层电子数,要注意根据电离能的突变分析,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列对电负性的理解不正确的是( )
| A、电负性是人为规定的一个相对数值,不是绝对标准 |
| B、元素电负性的大小反映了元素对键合电子引力的大小 |
| C、元素的电负性越大,则元素的非金属性越强 |
| D、元素的电负性是元素固有的性质,与原子结构无关 |
下列说法正确的是( )
| A、100mL1mol/L Al2(SO4)3溶液中,Al3+数为0.2×6.02×1023 |
| B、0.1mol锌与100mL1mol/L 的稀盐酸充分反应,产生氢气的分子数为0.1×6.02×1023 |
| C、C60和C70的混合物共12g,其中所含碳原子数为6.02×1023 |
| D、1mol甲基(-CH3)与1mol氢氧根(OH-)所含电子数均为10×6.02×1023 |




 实验室制得气体中常含有杂质,影响其性质检验.如图A为除杂装置,B为性质检验装置,完成下列表格:
实验室制得气体中常含有杂质,影响其性质检验.如图A为除杂装置,B为性质检验装置,完成下列表格: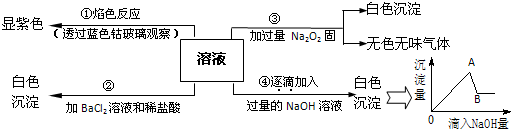
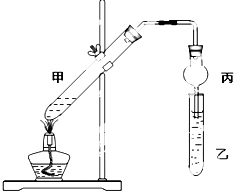 如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓慢加入2mL浓硫酸,充分摇匀,冷却后再加入2g无水乙酸.将试管甲固定在铁架台上,在试管乙中加入5mL饱和碳酸钠溶液,按如图连接好装置进行实验,当试管乙中有明显现象时停止实验.
如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓慢加入2mL浓硫酸,充分摇匀,冷却后再加入2g无水乙酸.将试管甲固定在铁架台上,在试管乙中加入5mL饱和碳酸钠溶液,按如图连接好装置进行实验,当试管乙中有明显现象时停止实验. 硫酸盐主要来自地层矿物质,多以硫酸钙、硫酸镁的形态存在.
硫酸盐主要来自地层矿物质,多以硫酸钙、硫酸镁的形态存在.