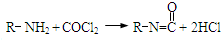题目内容
对于司机酒后驾车,可对其呼出的气体进行检查而查出,酒精可与红色的CrO3反应,使之转化为绿色的Cr(SO4)3,所利用的化学反应如下:
CrO3+ C2H5OH+ H2SO4= Cr2(SO4)3+ CH3CHO+ H2O
(1)被检测的气体成分是 ,上述反应中的氧化剂是 ;还原剂是 .
(2)配平上述反应方程式,并标出电子转移的方向和数目 .
(1)被检测的气体成分是
(2)配平上述反应方程式,并标出电子转移的方向和数目
考点:氧化还原反应方程式的配平,氧化还原反应的电子转移数目计算
专题:氧化还原反应专题
分析:该反应中Cr元素化合价由+6价变为+3价,C2H5OH中C元素化合价由-2价变为-1价,得电子的化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,其转移电子总数为6,根据转移电子相等、原子守恒配平方程式.
解答:
解:该反应中Cr元素化合价由+6价变为+3价,C2H5OH中C元素化合价由-2价变为-1价,转移电子总数为6,根据转移电子相等知,CrO3的计量数是2,C2H5OH的计量数是3,再结合原子守恒配平方程式为2CrO3+3C2H5OH+3H2SO4=Cr2(SO4)3+3CH3CHO+6H2O,
故答案为:2;3;3;1;3;6;
(1)呼出的气体中含有乙醇,所以被检测的气体成分是C2H5OH,得电子的化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,根据元素化合价知,氧化剂是CrO3、还原剂是C2H5OH,
故答案为:C2H5OH;CrO3;C2H5OH;
(2)根据以上分析知,其转移电子总数是6,则电子转移方向和数目为 ,
,
故答案为: .
.
故答案为:2;3;3;1;3;6;
(1)呼出的气体中含有乙醇,所以被检测的气体成分是C2H5OH,得电子的化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,根据元素化合价知,氧化剂是CrO3、还原剂是C2H5OH,
故答案为:C2H5OH;CrO3;C2H5OH;
(2)根据以上分析知,其转移电子总数是6,则电子转移方向和数目为
 ,
,故答案为:
 .
.
点评:本题考查氧化还原反应,侧重考查方程式的配平、基本概念等知识点,注意乙醇、乙醛中C元素采用平均值法确定其化合价,题目难度不大.

练习册系列答案
相关题目
下列依据相关实验得出的结论正确的是( )
| A、向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液 |
| B、用铂丝蘸取少量某溶液进行颜色反应,火焰呈黄色,该溶液一定是钠盐溶液 |
| C、Al、Fe、Cu对应的氧化物均能与酸反应生成盐和水,三种金属的氧化物均为碱性氧化物 |
| D、向某溶液中滴加氯水后,再滴加KSCN溶液后溶液显血红色,该溶液中不一定含Fe2+ |
设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、1 mol羟基(-OH)中含有的质子数为10 NA |
| B、相同状况下,22.4 L NO和11.2 L O2反应,生成物含有NA个分子 |
| C、在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移2 NA个电子 |
| D、1 mol Na2O2含有2 NA个阴离子 |
下列说法正确的是( )
| A、100mL1mol/L Al2(SO4)3溶液中,Al3+数为0.2×6.02×1023 |
| B、0.1mol锌与100mL1mol/L 的稀盐酸充分反应,产生氢气的分子数为0.1×6.02×1023 |
| C、C60和C70的混合物共12g,其中所含碳原子数为6.02×1023 |
| D、1mol甲基(-CH3)与1mol氢氧根(OH-)所含电子数均为10×6.02×1023 |
和氖原子有相同的电子层结构的微粒是( )
| A、He |
| B、K+ |
| C、Cl- |
D、 |
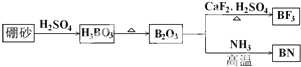
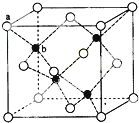
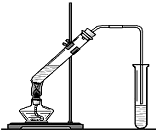 (1)装置中导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止
(1)装置中导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止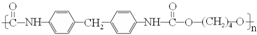 ),合成路线如图所示(部分反应试剂及生成物、条件省略).
),合成路线如图所示(部分反应试剂及生成物、条件省略).