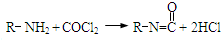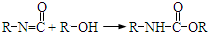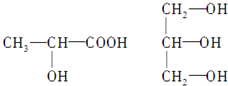题目内容
写出下列微粒的电子排布式
(1)S (2)Cr (3)Zn (4)O2- (5)Fe3+
(1) ;
(2) ;
(3) ;
(4) ;
(5) .
(1)S (2)Cr (3)Zn (4)O2- (5)Fe3+
(1)
(2)
(3)
(4)
(5)
考点:原子核外电子排布
专题:原子组成与结构专题
分析:处于最低能量的原子叫做基态原子,基态电子排布遵循能量最低原理、泡利不相容原理和洪特规则,根据元素符号,判断元素原子的核外电子数,再根据核外电子排布规律来写.
(1)S元素为16号元素,原子核外有16个电子,所以核外电子排布式为:1s22s22p63s23p4;
(2)Cr元素为24号元素,原子核外有24个电子,其电子排布式为1s22s22p63s23p63d54s1;
(3)Zn的原子序数为30,处于ds区,原子核外有30个电子,其电子排布式为1s22s22p63s23p63d104s2;
(4)O2-所含核外电子数为8+2=10,所以核外电子排布式为:1s22s22p6;
(5)铁原子失去最外层4s能级2个电子,然后失去3d能级上的1个电子形成Fe3+,核外电子排布式为:1s22s22p63s23p63d5;
(1)S元素为16号元素,原子核外有16个电子,所以核外电子排布式为:1s22s22p63s23p4;
(2)Cr元素为24号元素,原子核外有24个电子,其电子排布式为1s22s22p63s23p63d54s1;
(3)Zn的原子序数为30,处于ds区,原子核外有30个电子,其电子排布式为1s22s22p63s23p63d104s2;
(4)O2-所含核外电子数为8+2=10,所以核外电子排布式为:1s22s22p6;
(5)铁原子失去最外层4s能级2个电子,然后失去3d能级上的1个电子形成Fe3+,核外电子排布式为:1s22s22p63s23p63d5;
解答:
解:(1)S元素为16号元素,原子核外有16个电子,所以核外电子排布式为:1s22s22p63s23p4,故答案为:1s22s22p63s23p4;
(2)Cr元素为24号元素,原子核外有24个电子,其电子排布式为1s22s22p63s23p63d54s1,故答案为:1s22s22p63s23p63d54s1;
(3)Zn的原子序数为30,处于ds区,原子核外有30个电子,其电子排布式为1s22s22p63s23p63d104s2,故答案为:1s22s22p63s23p63d104s2;
(4)O2-所含核外电子数为8+2=10,所以核外电子排布式为:1s22s22p6,故答案为:1s22s22p6;
(5)铁原子失去最外层4s能级2个电子,然后失去3d能级上的1个电子形成Fe3+,核外电子排布式为:1s22s22p63s23p63d5,故答案为:1s22s22p63s23p63d5.
(2)Cr元素为24号元素,原子核外有24个电子,其电子排布式为1s22s22p63s23p63d54s1,故答案为:1s22s22p63s23p63d54s1;
(3)Zn的原子序数为30,处于ds区,原子核外有30个电子,其电子排布式为1s22s22p63s23p63d104s2,故答案为:1s22s22p63s23p63d104s2;
(4)O2-所含核外电子数为8+2=10,所以核外电子排布式为:1s22s22p6,故答案为:1s22s22p6;
(5)铁原子失去最外层4s能级2个电子,然后失去3d能级上的1个电子形成Fe3+,核外电子排布式为:1s22s22p63s23p63d5,故答案为:1s22s22p63s23p63d5.
点评:本题考查了基态原子的核外电子排布式,根据核外电子排布规律来写,注意电子处于全满、半满、全空时最稳定,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列说法正确的是( )
| A、100mL1mol/L Al2(SO4)3溶液中,Al3+数为0.2×6.02×1023 |
| B、0.1mol锌与100mL1mol/L 的稀盐酸充分反应,产生氢气的分子数为0.1×6.02×1023 |
| C、C60和C70的混合物共12g,其中所含碳原子数为6.02×1023 |
| D、1mol甲基(-CH3)与1mol氢氧根(OH-)所含电子数均为10×6.02×1023 |
下列有关表达正确的是( )
| A、硫离子的电子排布式:1s22s22p63s23p4 |
B、H2O的电子式: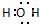 |
C、N原子最外层电子的轨道表示式: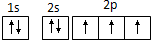 |
D、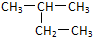 的名称:2-乙基丙烷 的名称:2-乙基丙烷 |
和氖原子有相同的电子层结构的微粒是( )
| A、He |
| B、K+ |
| C、Cl- |
D、 |
下列化学实验基本操作中,正确的是( )
| A、配制溶液时,将量筒中液体倒入烧杯后,应将量筒洗涤,将洗涤液也倒入烧杯 |
| B、用干燥的pH试纸分别测1mol?L-1的NaOH溶液和1mol?L-1的H2SO4的pH |
| C、稀释浓硫酸时,把浓硫酸慢慢倒入盛有水的烧杯中并不断搅拌 |
| D、向酒精灯加酒精时,应将试剂瓶中的酒精直接倒入酒精灯中 |
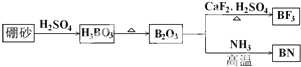
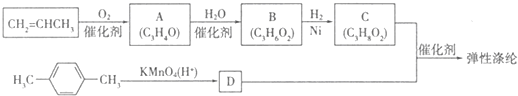
 ),合成路线如图所示(部分反应试剂及生成物、条件省略).
),合成路线如图所示(部分反应试剂及生成物、条件省略).