题目内容
17.下列实验操作与预期实验目的一致的是( )| 选项 | 实验操作 | 实验目的 |
| A | 溴乙烷在氢氧化钠溶液存在下加热水解后,加入硝酸银溶液 | 可用于检验溴元素的存在 |
| B | 苯中有少量苯酚,加入氢氧化钠溶液后,分液 | 可用于除去苯中的苯酚 |
| C | 乙烷中有少量乙烯,通入酸性KMnO4溶液中 | 可用于除去乙烷中的乙烯 |
| D | 测乙烯与溴水反应前后的pH | 可验证发生的是加成反应还是取代反应 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.在加入硝酸银溶液之前必须加入稀硝酸中和未反应的NaOH;
B.苯和NaOH不反应且分层,苯酚和NaOH生成可溶性的苯酚钠;
C.乙烯和酸性高锰酸钾溶液反应生成二氧化碳,乙烷和酸性高锰酸钾溶液不反应;
D.如果苯和溴发生加成反应时其pH变化不大,如果和溴发生取代反应时生成HBr,溶液酸性较强.
解答 解:A.在加入硝酸银溶液之前必须加入稀硝酸中和未反应的NaOH,否则硝酸银和NaOH反应生成黑色的氧化银而干扰实验,故A错误;
B.苯和NaOH不反应且分层,苯酚和NaOH生成可溶性的苯酚钠,然后采用分液方法分离提纯,故B正确;
C.乙烯和酸性高锰酸钾溶液反应生成二氧化碳,乙烷和酸性高锰酸钾溶液不反应,除去杂质又引进新的杂质,应该用溴水除去乙烷中的乙烯,故C错误;
D.如果苯和溴发生加成反应时其pH变化不大,如果和溴发生取代反应时生成HBr,溶液酸性较强,所以可以根据溶液pH大小确定发生反应类型,故D正确;
故选BD.
点评 本题考查化学实验方案评价,为高频考点,涉及反应类型判断、除杂、元素检验等知识点,侧重考查学生分析判断、实验操作等能力,明确实验原理、物质性质差异性等是解本题关键,注意:除杂时不能引进新的杂质,易错选项是AC.

练习册系列答案
相关题目
8.关于烯烃和烷烃的说法正确的是( )
| A. | 单烯烃和环烷烃互为同分异构体 | |
| B. | 分子式相差一个或多个“CH2”的有机物一定互为同系物 | |
| C. | 单烯烃的通式是CnH2n,则二烯烃的通式为CnH2n-2 | |
| D. | n>2时,CnH2n+2的同分异构体比CnH2n的同分异构体多 |
5.(1)下列变化中,①I2升华,②烧碱熔化,③NaCl溶于水,④HCl溶于水,⑤O2溶于水,⑥Na2O2溶于水.未发生化学键断裂的是①⑤;(填序号,下同)仅发生离子键断裂的是②③;仅发生共价键断裂的是④;即发生离子键断裂,又发生共价键断裂的是⑥;
(2)1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
(3)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如表:
四种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是MgO>CaO>NaCl>KCl.
(2)1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
(3)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如表:
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ•mol-1) | 786 | 715 | 3 401 |
12.下列有关化学用语表示正确的是( )
| A. | 乙炔的电子式: | B. | 对甲基苯酚的结构简式: | ||
| C. | 醛基的结构简式:-CHO | D. | 丙烷分子的比例模型为: |
9.下列关于乙烯和聚乙烯的叙述不正确的是( )
| A. | 乙烯常温下是气体,为纯净物;聚乙烯常温下是固体,为混合物 | |
| B. | 可以采用通过溴水洗气的方法以除去乙烷中的乙烯气体 | |
| C. | 乙烯和聚乙烯都能使溴水褪色 | |
| D. | 取等质量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等 |
10.钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质).
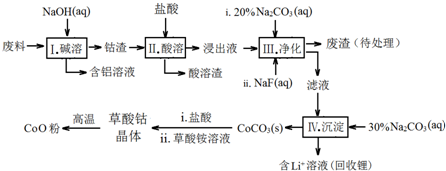
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见表:
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)步骤Ⅱ中Co2O3与盐酸反应的离子方程式Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O.
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应调节溶液的pH范围是3.2-7.15;废渣中的主要成分为Fe(OH)3、LiF.
(4)步骤Ⅲ中NaF参与的反应对步骤Ⅳ所起的作用是降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀.
(5)在空气中加热5.49g草酸钴晶体(CoC2O4•2H2O)样品,[M (CoC2O4•2H2O)=183g/mol]受热过程中不同温度范围内分别得到一种固体物质,其质量如表.
经测定,210~290℃过程中产生的气体只有CO2,此过程发生反应的化学方程式是3CoC2O4+2O2 $\frac{\underline{\;210℃-290℃\;}}{\;}$Co3O4+6CO2.

已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见表:
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)步骤Ⅱ中Co2O3与盐酸反应的离子方程式Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O.
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应调节溶液的pH范围是3.2-7.15;废渣中的主要成分为Fe(OH)3、LiF.
(4)步骤Ⅲ中NaF参与的反应对步骤Ⅳ所起的作用是降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀.
(5)在空气中加热5.49g草酸钴晶体(CoC2O4•2H2O)样品,[M (CoC2O4•2H2O)=183g/mol]受热过程中不同温度范围内分别得到一种固体物质,其质量如表.
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
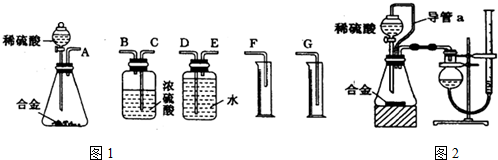
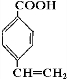 .
.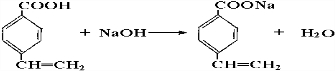 .
. .
.