题目内容
11.某工厂用含80%FeS2的黄铁矿制得硫酸122.5吨.取该硫酸2.45g加入水中稀释,然后再与足量的氯化钡溶液反应,得到4.66g沉淀.求:(1)所制得的H2SO4的质量分数为80%.
(2)制取122.5吨该硫酸所需黄铁矿多少吨?(列式计算)
(3)多硫化物(Na2Sx)(通常x=2~6),在制革工业中用作原皮的脱毛剂,农业上用来杀灭害虫.若上述这些黄铁矿通过一系列反应制取多硫化钠(Na2S3),可得到95%的多硫化钠(Na2S3)多少吨?(假定整个过程中硫损失5%)
分析 (1)4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,根据硫元素守恒,得到关系式:FeS2~2SO2~2SO2~2H2SO4,取该硫酸2.45克加入水中稀释,然后再与足量的氯化钡溶液反应,得到4.66g沉淀,沉淀是硫酸钡,物质的量是$\frac{4.66g}{233g/mol}$=0.02mol,硫酸和氯化钡反应方程式为H2SO4+BaCl2=BaSO4+2HCl,根据方程式知n(BaSO4)=n(H2SO4)=0.02mol,则m(H2SO4)=0.02mol×98g/mol=1.96g,硫酸的质量分数=$\frac{硫酸的质量}{硫酸溶液的质量}×100%$;
(2)根据硫元素守恒,得到关系式:FeS2~2SO2~2SO2~2H2SO4,根据硫酸和黄铜矿的关系式计算黄铜矿的质量;
(3)根据S原子守恒得关系式3FeS2~2Na2S3,根据二者的关系式计算生成多硫化钠的质量.
解答 解:(1)4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,根据硫元素守恒,得到关系式:FeS2~2SO2~2SO2~2H2SO4,取该硫酸2.45克加入水中稀释,然后再与足量的氯化钡溶液反应,得到4.66g沉淀,沉淀是硫酸钡,物质的量是$\frac{4.66g}{233g/mol}$=0.02mol,硫酸和氯化钡反应方程式为H2SO4+BaCl2=BaSO4+2HCl,根据方程式知n(BaSO4)=n(H2SO4)=0.02mol,则m(H2SO4)=0.02mol×98g/mol=1.96g,硫酸的质量分数=$\frac{硫酸的质量}{硫酸溶液的质量}×100%$=$\frac{1.96g}{2.45g}×100%$=80%,
故答案为:80%;
(2)根据硫元素守恒,得到关系式:FeS2~2SO2~2SO2~2H2SO4,
设消耗黄铜矿的质量为x,
FeS2~2SO2~2SO2~2H2SO4,
120 196
80%x 122.5t×80%
120:196=80%x:122.5t×80%
x=$\frac{122.5t×80%×120}{196×80%}$=75t
答:消耗80%黄铜矿的质量为75t;
(3)根据S原子守恒得关系式3FeS2~2Na2S3,
设生成多硫化钠的质量为y,
3FeS2 ~2Na2S3,
360 284
75t×80%×(1-5%) 95%y
360:284=75t×80%×(1-5%):95%y
y=$\frac{75t×80%×(1-5%)×284}{360×95%}$=47.3t,
答:可得到95%的多硫化钠(Na2S3)47.3t.
点评 本题考查化学方程式的有关计算,为高频考点,侧重考查学生分析计算能力,明确各个物理量之间的关系式是解本题关键,熟悉各个物理量之间的关系,题目难度不大.

 名校课堂系列答案
名校课堂系列答案| 选项 | 实验操作 | 实验目的 |
| A | 溴乙烷在氢氧化钠溶液存在下加热水解后,加入硝酸银溶液 | 可用于检验溴元素的存在 |
| B | 苯中有少量苯酚,加入氢氧化钠溶液后,分液 | 可用于除去苯中的苯酚 |
| C | 乙烷中有少量乙烯,通入酸性KMnO4溶液中 | 可用于除去乙烷中的乙烯 |
| D | 测乙烯与溴水反应前后的pH | 可验证发生的是加成反应还是取代反应 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 溶液是电中性的,胶体是带电的 | |
| B. | 直径介于1nm-100nm之间的微粒称为胶体 | |
| C. | 一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 | |
| D. | 溶液中溶质分子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 |
| A. | 盐酸、漂白粉都是混合物 | B. | 127I和131I互为同素异形体 | ||
| C. | 硫酸铜、蔗糖都是电解质 | D. | 分馏、干馏都是物理变化 |
 2015年诺贝尔奖获得者屠呦呦提取的抗疟新药青蒿素的结构简式,用键线式表示如图.
2015年诺贝尔奖获得者屠呦呦提取的抗疟新药青蒿素的结构简式,用键线式表示如图. ,需要在有机合成中引入羟基,引入羟基的反应类型有①②⑤.(选填编号)
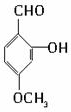
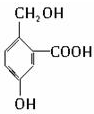
,需要在有机合成中引入羟基,引入羟基的反应类型有①②⑤.(选填编号) )可用于合成青蒿素,合成天然香草醛的反应如下:
)可用于合成青蒿素,合成天然香草醛的反应如下:
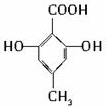
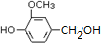 .
.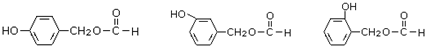 (其中之一).
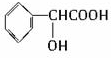
(其中之一). ;
;