题目内容
5.(1)下列变化中,①I2升华,②烧碱熔化,③NaCl溶于水,④HCl溶于水,⑤O2溶于水,⑥Na2O2溶于水.未发生化学键断裂的是①⑤;(填序号,下同)仅发生离子键断裂的是②③;仅发生共价键断裂的是④;即发生离子键断裂,又发生共价键断裂的是⑥;(2)1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
(3)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如表:
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ•mol-1) | 786 | 715 | 3 401 |
分析 (1)未破坏化学键说明没有发生化学反应或没有电解质熔融或溶于水,属于物理变化;仅离子化合物溶于水或熔融或发生化学反应离子键被破坏;仅共价键被破坏说明原子晶体熔融或共价化合物(或单质)溶于水以及发生化学反应;离子键和共价键同时被破坏说明该物质发生化学反应;
(2)影响晶体晶格能大小的因素有离子半径以及离子所带电荷的多少,晶格能越大熔点越高;
解答 解:(1)①I2升华 ⑤O2溶于水未破坏化学键;烧碱融化③NaCl溶于水仅离子键被破坏;④HCl溶于水发生电离,仅共价键被破坏;⑥Na2O2 溶于水生成氢氧化钠和氧气,离子键和共价键同时被破坏,故答案为:①⑤;②③;④;⑥;
(2)离子半径Mg2+<Na+<O2-<Ca2+<Cl-;离子电荷数Na+=Cl-<O2-=Mg2+=Ca2+,离子晶体的离子半径越小,带电荷数越多,晶格能越大,则晶体的熔沸点越高,则有NaCl、KCl、MgO、CaO熔点由高到低的顺序是MgO>CaO>NaCl>KCl,故答案为:MgO>CaO>NaCl>KCl.
点评 本题考查了化学键的破坏,明确化学键被破坏的条件是解本题关键,再结合微粒间存在的作用力分析解答,注意有化学键被破坏不一定发生化学反应,但发生化学反应化学键一定被破坏.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.通常情况下,下列各组气体不能共存的是( )
| A. | N2和O2 | B. | H2和Cl2 | C. | H2和O2 | D. | NO和O2 |
20.表列出了7种短周期元素在元素周期表中的相对位置,其中元素①的最低负化合价的绝对值与其原子最外层电子数相等,元素⑤是地壳中含量最多的金属元素.
请用相应的化学用语回答下列问题:
(1)元素①在元素周期表中所处的位置是第二周期、第ⅣA族.
(2)上述7中元素中,非金属性最强的是O(填元素符号);最高价氧化物对应水化物中,碱性最强的物质的化学式是NaOH.
(3)③、⑥、⑦三种元素形成的简单气态氢化物的稳定性由强到弱的顺序是H2O>H2S>SiH4.
(4)元素④和⑤各自的最高价氧化物对应水化物相互间发生反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
(5)化合物甲是元素②形成的最简单氢化物,甲的电子式是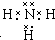 .在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所得产物不污染环境,其化学方程式是2NH3•H2O+3H2O2=N2↑+8H2O或2NH3+3H2O2=N2+6H2O.
.在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所得产物不污染环境,其化学方程式是2NH3•H2O+3H2O2=N2↑+8H2O或2NH3+3H2O2=N2+6H2O.
| ① | ② | ③ | |||
| ④ | ⑤ | ⑥ | ⑦ |
(1)元素①在元素周期表中所处的位置是第二周期、第ⅣA族.
(2)上述7中元素中,非金属性最强的是O(填元素符号);最高价氧化物对应水化物中,碱性最强的物质的化学式是NaOH.
(3)③、⑥、⑦三种元素形成的简单气态氢化物的稳定性由强到弱的顺序是H2O>H2S>SiH4.
(4)元素④和⑤各自的最高价氧化物对应水化物相互间发生反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
(5)化合物甲是元素②形成的最简单氢化物,甲的电子式是
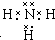 .在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所得产物不污染环境,其化学方程式是2NH3•H2O+3H2O2=N2↑+8H2O或2NH3+3H2O2=N2+6H2O.
.在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所得产物不污染环境,其化学方程式是2NH3•H2O+3H2O2=N2↑+8H2O或2NH3+3H2O2=N2+6H2O.
10.如表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号,下同),原子结构示意图为 ;元素⑩名称为溴在周期表中的位置第四周期ⅤⅡA族.
;元素⑩名称为溴在周期表中的位置第四周期ⅤⅡA族.
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的化学式是:NaOH.
(3)③、④、⑥三种元素形成的离子,离子半径由大到小的顺序是S2->O2->Na+.
(4)最高价氧化物是两性氧化物,该两性氧化物与氢氧化钠反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O.
(5)元素③的氢化物常温下和元素⑦的单质反应的离子方程式为Cl2+H2O=H++Cl-+HClO.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 ;元素⑩名称为溴在周期表中的位置第四周期ⅤⅡA族.
;元素⑩名称为溴在周期表中的位置第四周期ⅤⅡA族.(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的化学式是:NaOH.
(3)③、④、⑥三种元素形成的离子,离子半径由大到小的顺序是S2->O2->Na+.
(4)最高价氧化物是两性氧化物,该两性氧化物与氢氧化钠反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O.
(5)元素③的氢化物常温下和元素⑦的单质反应的离子方程式为Cl2+H2O=H++Cl-+HClO.
17.下列实验操作与预期实验目的一致的是( )
| 选项 | 实验操作 | 实验目的 |
| A | 溴乙烷在氢氧化钠溶液存在下加热水解后,加入硝酸银溶液 | 可用于检验溴元素的存在 |
| B | 苯中有少量苯酚,加入氢氧化钠溶液后,分液 | 可用于除去苯中的苯酚 |
| C | 乙烷中有少量乙烯,通入酸性KMnO4溶液中 | 可用于除去乙烷中的乙烯 |
| D | 测乙烯与溴水反应前后的pH | 可验证发生的是加成反应还是取代反应 |
| A. | A | B. | B | C. | C | D. | D |
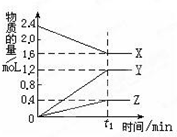 某温度下,在2L密闭容器中,3种气态物质X、Y、Z的物质的量随时间 变化曲线如图.
某温度下,在2L密闭容器中,3种气态物质X、Y、Z的物质的量随时间 变化曲线如图. ;
;