题目内容
12.下列有关化学用语表示正确的是( )| A. | 乙炔的电子式: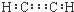 | B. | 对甲基苯酚的结构简式: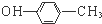 | ||
| C. | 醛基的结构简式:-CHO | D. | 丙烷分子的比例模型为: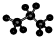 |
分析 A、乙炔中碳原子间为碳碳三键;
B、羟基书写不规范,硝基正确表示应该为:HO-;
C、醛基中含有1个碳氢键和1个碳氧双键,该表示方法不规范;
D.丙烷分子中存在2个甲基和1个亚甲基,根据球棍模型的表示方法判断.
解答 解:A、乙炔中碳原子最外层有4个电子,要达到稳定结构要形成四对共用电子对,而1个氢原子只能与1个碳原子形成形成1对公用电子对,所以碳原子和碳原子间只能形成3对公用电子对,所以乙炔的电子式为 ,故A错误;
,故A错误;
B、对羟基苯甲酸,应是羟基中的O与苯环相连,正确结构简式为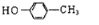 ,故B错误;
,故B错误;
C、醛基中O原子和H原子直接连在碳原子上,故结构简式为:-CHO,故C正确;
D.用小球和短棍表示原子和化学键即为球棍模型,丙烷分子的球棍模型为: ,故D错误;
,故D错误;
故选C.
点评 本题考查了常见化学用语的表示方法判断,题目难度中等,注意掌握离子结构示意图、电子式、元素符号、结构式等化学用语的书写原则,明确离子结构示意图与原子结构示意图、离子化合物与共价化合物的电子式的区别,试题侧重考查学生的规范答题的能力.

练习册系列答案
相关题目
2.结构简式为 的有机物在一定条件下能和氢气完全加成,加成产物的一溴代物有(不考虑-OH的取代)( )
的有机物在一定条件下能和氢气完全加成,加成产物的一溴代物有(不考虑-OH的取代)( )
 的有机物在一定条件下能和氢气完全加成,加成产物的一溴代物有(不考虑-OH的取代)( )
的有机物在一定条件下能和氢气完全加成,加成产物的一溴代物有(不考虑-OH的取代)( )| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
20.表列出了7种短周期元素在元素周期表中的相对位置,其中元素①的最低负化合价的绝对值与其原子最外层电子数相等,元素⑤是地壳中含量最多的金属元素.
请用相应的化学用语回答下列问题:
(1)元素①在元素周期表中所处的位置是第二周期、第ⅣA族.
(2)上述7中元素中,非金属性最强的是O(填元素符号);最高价氧化物对应水化物中,碱性最强的物质的化学式是NaOH.
(3)③、⑥、⑦三种元素形成的简单气态氢化物的稳定性由强到弱的顺序是H2O>H2S>SiH4.
(4)元素④和⑤各自的最高价氧化物对应水化物相互间发生反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
(5)化合物甲是元素②形成的最简单氢化物,甲的电子式是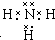 .在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所得产物不污染环境,其化学方程式是2NH3•H2O+3H2O2=N2↑+8H2O或2NH3+3H2O2=N2+6H2O.
.在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所得产物不污染环境,其化学方程式是2NH3•H2O+3H2O2=N2↑+8H2O或2NH3+3H2O2=N2+6H2O.
| ① | ② | ③ | |||
| ④ | ⑤ | ⑥ | ⑦ |
(1)元素①在元素周期表中所处的位置是第二周期、第ⅣA族.
(2)上述7中元素中,非金属性最强的是O(填元素符号);最高价氧化物对应水化物中,碱性最强的物质的化学式是NaOH.
(3)③、⑥、⑦三种元素形成的简单气态氢化物的稳定性由强到弱的顺序是H2O>H2S>SiH4.
(4)元素④和⑤各自的最高价氧化物对应水化物相互间发生反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
(5)化合物甲是元素②形成的最简单氢化物,甲的电子式是
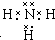 .在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所得产物不污染环境,其化学方程式是2NH3•H2O+3H2O2=N2↑+8H2O或2NH3+3H2O2=N2+6H2O.
.在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所得产物不污染环境,其化学方程式是2NH3•H2O+3H2O2=N2↑+8H2O或2NH3+3H2O2=N2+6H2O.
17.下列实验操作与预期实验目的一致的是( )
| 选项 | 实验操作 | 实验目的 |
| A | 溴乙烷在氢氧化钠溶液存在下加热水解后,加入硝酸银溶液 | 可用于检验溴元素的存在 |
| B | 苯中有少量苯酚,加入氢氧化钠溶液后,分液 | 可用于除去苯中的苯酚 |
| C | 乙烷中有少量乙烯,通入酸性KMnO4溶液中 | 可用于除去乙烷中的乙烯 |
| D | 测乙烯与溴水反应前后的pH | 可验证发生的是加成反应还是取代反应 |
| A. | A | B. | B | C. | C | D. | D |
4.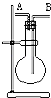 某学生想利用如图装置(烧瓶位置不能移动)收集下列气体:①H2; ②Cl2;③SO2;④HCl;⑤NH3;⑥NO;⑦NO2.下列说法正确的是( )
某学生想利用如图装置(烧瓶位置不能移动)收集下列气体:①H2; ②Cl2;③SO2;④HCl;⑤NH3;⑥NO;⑦NO2.下列说法正确的是( )
 某学生想利用如图装置(烧瓶位置不能移动)收集下列气体:①H2; ②Cl2;③SO2;④HCl;⑤NH3;⑥NO;⑦NO2.下列说法正确的是( )
某学生想利用如图装置(烧瓶位置不能移动)收集下列气体:①H2; ②Cl2;③SO2;④HCl;⑤NH3;⑥NO;⑦NO2.下列说法正确的是( )| A. | 烧瓶是干燥的,由B进气,可收集②③④⑥⑦ | |
| B. | 烧瓶是干燥的,由A进气,可收集①⑤ | |
| C. | 在烧瓶中充满水,由A进气,可收集①⑤⑦ | |
| D. | 在烧瓶中充满水,由B进气,可收集⑥ |
6.下列叙述正确的是( )
| A. | 溶液是电中性的,胶体是带电的 | |
| B. | 直径介于1nm-100nm之间的微粒称为胶体 | |
| C. | 一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 | |
| D. | 溶液中溶质分子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 |
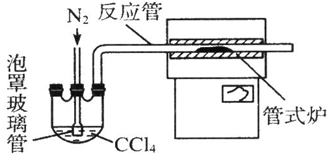
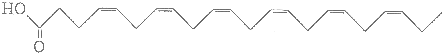
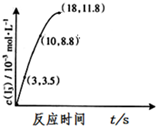 臭氧是一种强氧化剂可与碘化钾水溶液发生反应生成氧气和单质碘.向反应后的溶液中滴入酚酞,溶液变为红色.
臭氧是一种强氧化剂可与碘化钾水溶液发生反应生成氧气和单质碘.向反应后的溶液中滴入酚酞,溶液变为红色.