题目内容
9.下列关于乙烯和聚乙烯的叙述不正确的是( )| A. | 乙烯常温下是气体,为纯净物;聚乙烯常温下是固体,为混合物 | |
| B. | 可以采用通过溴水洗气的方法以除去乙烷中的乙烯气体 | |
| C. | 乙烯和聚乙烯都能使溴水褪色 | |
| D. | 取等质量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等 |
分析 乙烯含有碳碳双键,可发生加成、加聚和氧化反应,乙烯加聚生成聚乙烯,聚乙烯不含碳碳双键,二者分子式不同,结构不同,实验式相同,以此解答.
解答 解:A.乙烯的结构简式为H2C=CH2,聚乙烯的 ,聚乙烯中的n不同聚乙烯物质就不同,所以乙烯是纯净物,聚乙烯是混合物,故A正确;
,聚乙烯中的n不同聚乙烯物质就不同,所以乙烯是纯净物,聚乙烯是混合物,故A正确;
B.乙烯含有碳碳双键,可与溴水发生加成反应而除去,故B正确;
C.乙烯中含有碳碳双键,聚乙烯中不含碳碳双键,所以乙烯能和溴发生加成反应,而聚乙烯不能和溴发生加成反应,故C错误;
D.乙烯和聚乙烯的化学式不同,但最简式相同都是CH2,所以乙烯和聚乙烯中的含碳量、含氢量相同,所以取等质量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等,故D正确.
故选C.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,题目涉及乙烯和聚乙烯的异同,明确乙烯和聚乙烯的结构是解本题的关键,难度不大,注意聚乙烯不能发生加成反应.

练习册系列答案
相关题目
19.下列关于元素周期表的说法中,正确的是( )
| A. | 元素周期表有 18 个族 | |
| B. | 1-20 号元素称为短周期元素 | |
| C. | 元素周期表中有 7 个主族,7 个副族 | |
| D. | 零族元素原子最外层均为 8 个电子 |
20.表列出了7种短周期元素在元素周期表中的相对位置,其中元素①的最低负化合价的绝对值与其原子最外层电子数相等,元素⑤是地壳中含量最多的金属元素.
请用相应的化学用语回答下列问题:
(1)元素①在元素周期表中所处的位置是第二周期、第ⅣA族.
(2)上述7中元素中,非金属性最强的是O(填元素符号);最高价氧化物对应水化物中,碱性最强的物质的化学式是NaOH.
(3)③、⑥、⑦三种元素形成的简单气态氢化物的稳定性由强到弱的顺序是H2O>H2S>SiH4.
(4)元素④和⑤各自的最高价氧化物对应水化物相互间发生反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
(5)化合物甲是元素②形成的最简单氢化物,甲的电子式是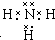 .在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所得产物不污染环境,其化学方程式是2NH3•H2O+3H2O2=N2↑+8H2O或2NH3+3H2O2=N2+6H2O.
.在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所得产物不污染环境,其化学方程式是2NH3•H2O+3H2O2=N2↑+8H2O或2NH3+3H2O2=N2+6H2O.
| ① | ② | ③ | |||
| ④ | ⑤ | ⑥ | ⑦ |
(1)元素①在元素周期表中所处的位置是第二周期、第ⅣA族.
(2)上述7中元素中,非金属性最强的是O(填元素符号);最高价氧化物对应水化物中,碱性最强的物质的化学式是NaOH.
(3)③、⑥、⑦三种元素形成的简单气态氢化物的稳定性由强到弱的顺序是H2O>H2S>SiH4.
(4)元素④和⑤各自的最高价氧化物对应水化物相互间发生反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
(5)化合物甲是元素②形成的最简单氢化物,甲的电子式是
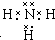 .在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所得产物不污染环境,其化学方程式是2NH3•H2O+3H2O2=N2↑+8H2O或2NH3+3H2O2=N2+6H2O.
.在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所得产物不污染环境,其化学方程式是2NH3•H2O+3H2O2=N2↑+8H2O或2NH3+3H2O2=N2+6H2O.
17.下列实验操作与预期实验目的一致的是( )
| 选项 | 实验操作 | 实验目的 |
| A | 溴乙烷在氢氧化钠溶液存在下加热水解后,加入硝酸银溶液 | 可用于检验溴元素的存在 |
| B | 苯中有少量苯酚,加入氢氧化钠溶液后,分液 | 可用于除去苯中的苯酚 |
| C | 乙烷中有少量乙烯,通入酸性KMnO4溶液中 | 可用于除去乙烷中的乙烯 |
| D | 测乙烯与溴水反应前后的pH | 可验证发生的是加成反应还是取代反应 |
| A. | A | B. | B | C. | C | D. | D |
4.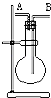 某学生想利用如图装置(烧瓶位置不能移动)收集下列气体:①H2; ②Cl2;③SO2;④HCl;⑤NH3;⑥NO;⑦NO2.下列说法正确的是( )
某学生想利用如图装置(烧瓶位置不能移动)收集下列气体:①H2; ②Cl2;③SO2;④HCl;⑤NH3;⑥NO;⑦NO2.下列说法正确的是( )
 某学生想利用如图装置(烧瓶位置不能移动)收集下列气体:①H2; ②Cl2;③SO2;④HCl;⑤NH3;⑥NO;⑦NO2.下列说法正确的是( )
某学生想利用如图装置(烧瓶位置不能移动)收集下列气体:①H2; ②Cl2;③SO2;④HCl;⑤NH3;⑥NO;⑦NO2.下列说法正确的是( )| A. | 烧瓶是干燥的,由B进气,可收集②③④⑥⑦ | |
| B. | 烧瓶是干燥的,由A进气,可收集①⑤ | |
| C. | 在烧瓶中充满水,由A进气,可收集①⑤⑦ | |
| D. | 在烧瓶中充满水,由B进气,可收集⑥ |
 臭氧是一种强氧化剂可与碘化钾水溶液发生反应生成氧气和单质碘.向反应后的溶液中滴入酚酞,溶液变为红色.
臭氧是一种强氧化剂可与碘化钾水溶液发生反应生成氧气和单质碘.向反应后的溶液中滴入酚酞,溶液变为红色. 2015年诺贝尔奖获得者屠呦呦提取的抗疟新药青蒿素的结构简式,用键线式表示如图.
2015年诺贝尔奖获得者屠呦呦提取的抗疟新药青蒿素的结构简式,用键线式表示如图. ,需要在有机合成中引入羟基,引入羟基的反应类型有①②⑤.(选填编号)
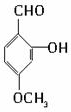
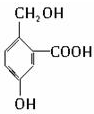
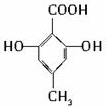
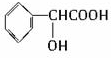
,需要在有机合成中引入羟基,引入羟基的反应类型有①②⑤.(选填编号) )可用于合成青蒿素,合成天然香草醛的反应如下:
)可用于合成青蒿素,合成天然香草醛的反应如下:
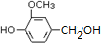 .
.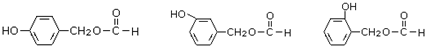 (其中之一).
(其中之一).