题目内容
10.I.2015年国产C919大型客机正式下线,标志着我国成为世界上少数几个具有自行研制大型飞机的国家之一,标志着我国航空工业进入了新的发展阶段.(1)飞机的外壳通常采用镁-铝合金材料,铝的价电子排布图为
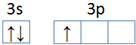 ,第一电离能:镁大于(填“大于”或“小于”)铝.
,第一电离能:镁大于(填“大于”或“小于”)铝.(2)现代飞机为了减轻质量而不减轻外壳承压能力,通常采用复合材料--玻璃纤维增强塑料,其成分之一为环氧树脂,常见的E51型环氧树脂中部分结构如1图所示:
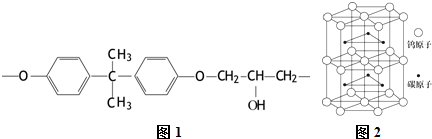
其中碳原子的杂化方式为sp2、sp3,个数比为2:1.
II.大型飞机的发动机被誉为航空工业皇冠上的“宝石”.制造过程中通常采用碳化钨做关键部位的材料.
(3)钨元素位于周期表的第六周期第VIB族,请写出其外围电子排布式5d46s2,
(4)图2为碳化钨晶体的一部分结构,碳原子嵌入金属钨的晶格的间隙,并不破坏原有金属的晶格,形成填隙+固溶体,也称为填隙化合物.在此结构中,其中钨原子有6个,1个钨原子周围距离钨原子最近的碳原子有6个,下列金属元素的堆积方式与碳化钨晶胞中碳原子和钨原子所处位置类似的是C.
A.Fe CuB.Ti AuC.Mg ZnD.Cu Ag
(5)假设该部分晶体的体积为Vcm3,碳化钨的摩尔质量为M g/mol,密度为b g/cm3,则阿伏加德罗常数NA用上述数据可以表示为$\frac{4M}{bV}$.
分析 I.(1)Al原子价电子排布式为3s23p1,根据泡利原理、洪特规则画出价电子排布图;Mg元素3s能级为全满稳定状态,第一电离能高于同周期相邻元素的;
(2)分子中碳原子均没有孤对电子,苯环中C原子形成3个σ键、其它碳原子生成4个σ键,杂化轨道数目分别为3、4;
II.(3)钨元素位于周期表的第六周期第VIB族,据此书写其外围电子排布式;
(4)利用均摊法计算钨原子数目,以体内钨原子可知,1个钨原子周围距离钨原子最近的碳原子有6个,碳化钨晶胞中碳原子和钨原子所处位置为六方最密堆积,与Mg的堆积方式相同;
(5)计算结构中W、C原子数目,利用阿伏伽德罗常数表示出质量,再根据m=ρV计算.
解答 解:I.(1)Al原子价电子排布式为3s23p1,价电子排布图为,Mg元素3s能级为全满稳定状态,能量较低,Mg的第一电离能大于Al的,
故答案为: ;大于;
;大于;
(2)分子中碳原子均没有孤对电子,苯环中C原子形成3个σ键、其它碳原子生成4个σ键,杂化轨道数目分别为3、4,分别采取sp2、sp3 杂化,二者原子数目之比为12:6=2:1,
故答案为:sp2、sp3;2:1;
II.(3)钨元素位于周期表的第六周期第VIB族,其外围电子排布式为:5d46s2,
故答案为:5d46s2;
(4)在此结构中钨原子数目为1+2×$\frac{1}{2}$+12×$\frac{1}{6}$+6×$\frac{1}{3}$=6,以体内钨原子可知,1个钨原子周围距离钨原子最近的碳原子有6个,碳化钨晶胞中碳原子和钨原子所处位置为六方最密堆积,与Mg的堆积方式相同,
故答案为:6;6;C;
(5)结构中W原子数目为6、C原子数目为6,则结构质量为4×$\frac{Mg/mol}{{N}_{A}mo{l}^{-1}}$,则4×$\frac{Mg/mol}{{N}_{A}mo{l}^{-1}}$=Vcm3×b g/cm3,故NA=$\frac{4M}{bV}$,
故答案为:$\frac{4M}{bV}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、杂化方式、晶胞结构与计算等,注意识记中学常见晶胞结构,掌握均摊法进行晶胞的有关计算,(3)中价电子书写为易错点,识记元素周期表中特殊情况.

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案| A. | HCl→Cl2 | B. | MnO4→Mn2+ | C. | SO3→SO42- | D. | CO2→CO |
| A. | 高纯度的单晶硅可用于制造太阳能电池板和光导纤维 | |
| B. | 石油可以通过裂解、裂化等物理变化获得重要化工原料乙烯 | |
| C. | 鸡蛋清和淀粉溶液都属于胶体,遇到硫酸铜溶液可以发生胶体聚沉 | |
| D. | 植物油中由于含有碳碳双键,因此在空气中长时间放置容易氧化变质 |
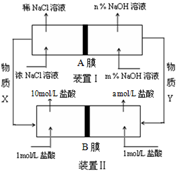 将氯碱工业与燃料电池联合能够有效降低能源消耗,如图是该工艺的图示(电源及电极未标出),则下列说法错误的是( )
将氯碱工业与燃料电池联合能够有效降低能源消耗,如图是该工艺的图示(电源及电极未标出),则下列说法错误的是( )| A. | 装置I为电解池,装置II为原电池 | |
| B. | 物质X为氯气,物质Y为氢气 | |
| C. | A膜为阳离子交换膜,B膜为阴离子交换膜 | |
| D. | 装置Ⅰ中,m小于n,装置II中a等于1 |
| 选项 | 陈述I | 陈述II |
| A | 油脂和汽油都是油 | 一定条件下都能发生皂化反应 |
| B | CuSO4可以用作游泳池消毒剂 | 铜盐能使蛋白质变性 |
| C | 蔗糖、淀粉、纤维素是还原性糖 | 它们一定条件下都能发生银镜反应 |
| D | 蛋白质结构中存在肽键 | 蛋白质能表现出两性 |
| A. | A | B. | B | C. | C | D. | D |
| A. | pH=6,显弱酸性 | B. | [H+]=10-6mo1•L-1,溶液为中性 | ||
| C. | [OH-]=10-6mo1•L-1,溶液为碱性 | D. | 温度不变稀释10倍,pH=7 |

 +Br2
+Br2
 +HO-NO2
+HO-NO2
 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$
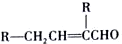
 .
. .
.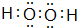 ,其所含化学键为(选代码)bc.
,其所含化学键为(选代码)bc.