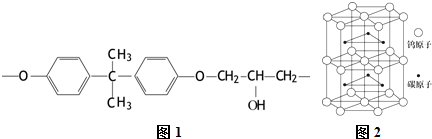
题目内容
20.下列物质转化关系中,需要加入适当氧化剂的是( )| A. | HCl→Cl2 | B. | MnO4→Mn2+ | C. | SO3→SO42- | D. | CO2→CO |
分析 加入适当氧化剂,则选项中为还原剂的反应,还原剂中某元素的化合价升高,以此来解答.
解答 解:A.HCl→Cl2中,Cl元素的化合价升高,需要加氧化剂,故A选;
B.KMnO4→Mn2+中,Mn元素的化合价降低,加还原剂,故B不选;
C.SO3→SO42-中,S元素的化合价不变,不发生氧化还原反应,故C不选;
D.CO2→CO中,C元素的化合价降低,加还原剂,故D不选;
故选A.
点评 本题考查氧化还原反应,侧重氧化剂、还原剂中元素的化合价变化的考查,明确反应中还原剂中某元素的化合价升高即可解答,题目难度不大.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
11.据最新报道:用10B合成的10B20分子有非常好的抗癌作用.下列说法正确的是( )
| A. | 10B的质子数是10 | B. | 10B的中子数与核外电子数不同 | ||
| C. | 10B20是一种新合成的化合物 | D. | 10B20具有较强的化学活性 |
8.某同学在实验中不小心将几滴新制氯水滴入盛有溴化亚铁溶液的试剂瓶中,发现溶液变成了黄色,根据已有化学知识,请你参与上述现象形成原因的分析与探究:
(1)提出问题猜想:
猜想一:溶液呈黄色是因发生离子反应①2Fe2++Cl2=2Fe3++2Cl-(填离子方程式)所致.
猜想二:溶液呈黄色是因发生离子反应②2Br-+Cl2=Br2+2Cl-(填离子方程式)所致.
(2)设计实验并验证
为验证①与②中是哪个原因导致了溶液变黄色,设计并进行了以下实验.请根据以下所给试剂,进行合理选用,完成实验方案1和方案2:
(3)实验结论:以上实验不仅验证了溶液变黄的真实原因,同时证明了Fe2+的还原性比Br-强(填“强”或“弱”).
(4)实验反思
I.根据上述实验推测,若在溴化亚铁溶液中滴入足量氯水,再加入CCl4并充分振荡后静止,产生的现象是溶液分层,上层为黄色、下层为橙红色.
Ⅱ.在100mLFeBr2溶液中通入2.24L Cl2(标准状况),溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1mol/L.
(1)提出问题猜想:
猜想一:溶液呈黄色是因发生离子反应①2Fe2++Cl2=2Fe3++2Cl-(填离子方程式)所致.
猜想二:溶液呈黄色是因发生离子反应②2Br-+Cl2=Br2+2Cl-(填离子方程式)所致.
(2)设计实验并验证
为验证①与②中是哪个原因导致了溶液变黄色,设计并进行了以下实验.请根据以下所给试剂,进行合理选用,完成实验方案1和方案2:
| 试剂 | 酚酞试液、CCl4、无水酒精、KSCN溶液 | ||
| 方案 | 操作步骤 | 实验现象 | 结论 |
| 1 | 取所述黄色溶液于试管中,滴加KSCN溶液并振荡 | 溶液变红色 | 反应①所致 |
| 2 | 取所述黄色溶液于试管中,滴加CCl4并振荡 | 溶液分上下两层,上层为黄色、下层为无色 | |
(4)实验反思
I.根据上述实验推测,若在溴化亚铁溶液中滴入足量氯水,再加入CCl4并充分振荡后静止,产生的现象是溶液分层,上层为黄色、下层为橙红色.
Ⅱ.在100mLFeBr2溶液中通入2.24L Cl2(标准状况),溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1mol/L.
5.下列离子方程式书写正确的是( )
| A. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | Cu与稀硝酸的反应 3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | CaCO3与盐酸反应 CO32-+2H+═CO2↑+H2O | |
| D. | 实验室用浓盐酸和二氧化锰反应 MnO2+2H++2Cl-═Mn2++Cl2↑+H2O |
12.下列各组反应的最终产物中,肯定有白色沉淀的是( )
| A. | 向AlCl3溶液中加入过量氨水 | B. | 向Al2(SO4)3溶液中加入过量KOH溶液 | ||
| C. | 向澄清石灰水中通入过量CO2 | D. | 向NaAlO2溶液中加入过量稀盐酸 |
9.配制100mL 1mol/LNaOH溶液,下列说法正确的是( )
| A. | 在托盘天平两托盘上各放一片相同的纸,然后将NaOH放在纸片上进行称量 | |
| B. | 配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出 | |
| C. | 用蒸馏水洗涤烧杯、玻璃棒2-3次,洗涤液也移入容量瓶中 | |
| D. | 定容时俯视容量瓶的刻度线,会造成所配溶液物质的量浓度偏低 |
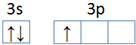 ,第一电离能:镁大于(填“大于”或“小于”)铝.
,第一电离能:镁大于(填“大于”或“小于”)铝.