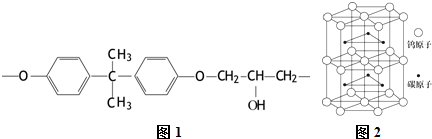
题目内容
5.下列说法中正确的是( )| A. | 高纯度的单晶硅可用于制造太阳能电池板和光导纤维 | |
| B. | 石油可以通过裂解、裂化等物理变化获得重要化工原料乙烯 | |
| C. | 鸡蛋清和淀粉溶液都属于胶体,遇到硫酸铜溶液可以发生胶体聚沉 | |
| D. | 植物油中由于含有碳碳双键,因此在空气中长时间放置容易氧化变质 |
分析 A.硅为良好的半导体材料,二氧化硅具有对光的全反射作用;
B.裂化就是在一定的条件下,将相对分子质量较大、沸点较高的烃断裂为相对分子质量较小、沸点较低的烃的过程,裂解是石油化工生产过程中,以比裂化更高的温度(700℃~800℃,有时甚至高达1000℃以上),使石油分馏产物(包括石油气)中的长链烃断裂成乙烯、丙烯等短链烃的加工过程;
C.硫酸铜溶液能使鸡蛋清发生变性;
D.植物油中由于含有碳碳双键,易被氧化而变质.
解答 解:A.硅为良好的半导体材料,二氧化硅具有对光的全反射作用,则高纯度的单晶硅可用于制造太阳能电池板,而二氧化硫为光导纤维的材料,故A错误;
B.石油可以通过裂解、裂化等化学变化获得重要化工原料乙烯,故B错误;
C.鸡蛋清和淀粉溶液都属于胶体,硫酸铜溶液能使鸡蛋清发生变性,使淀粉溶液发生聚沉,故C错误;
D.植物油中由于含有碳碳双键,易被氧化而变质,因此在空气中长时间放置容易氧化变质,故D正确;
故选D.
点评 本题考查有机物的结构与性质,为高考常见题型,侧重于考查学生的分析能力和应用能力,注意把握官能团与性质的关系、有机反应为解答的关键,注意化学与生活的联系,题目难度不大.

练习册系列答案
相关题目
13.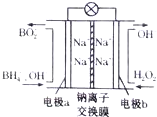 据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,其负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,其负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )
 据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,其负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,其负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )| A. | 该电池的负极反应为BH4-+8OH--8e-═BO2-+6H2O | |
| B. | 电池放电时Na+从b极区移向a极区 | |
| C. | 每消耗3mol H2O2,转移的电子为3mol | |
| D. | 电极a采用Mn02作电极材料 |
20.设NA为阿伏加德罗常数,下列叙述中正确的是( )
| A. | 78 g Na2O2中存在的共价键总数为NA | |
| B. | 0.1 mol${\;}_{38}^{90}$Sr原子中含中子数为3.8NA | |
| C. | 氢氧燃料电池负极消耗2.24 L气体时,电路中转移的电子数为0.1NA | |
| D. | 0.1 mol氯化铁溶于1L水中,所得溶液中Fe3+的数目为0.1NA |
17. 利用合成气(主要成分为CO、CO2和H2)合成甲醇,发生的主要反应如下:
利用合成气(主要成分为CO、CO2和H2)合成甲醇,发生的主要反应如下:
Ⅰ.CO(g)+2H2(g)?催化剂CH3OH(g)△H1
Ⅱ.CO2(g)+H2(g)?催化剂CO(g)+H2O(g)△H2
Ⅲ.CO2(g)+3H2(g)?催化剂CH3OH(g)+H2O(g)△H3
(1)上述反应达到平衡时对应的氢气的百分含量分别为a1、a2、a3,它们随温度变化的曲线如图所示.则△H2> (填“>”、“<”或“=”) 0,判断理由是升温平衡向吸热反应方向进行;△H1<△H3(填“>”、“<”或“=”).
(2)在温度T时,向某容器中充入1mol CO2和3mol H2,发生反应Ⅲ的反应.
①如果该容器为恒压容器,维持体系总压强p恒定,达到平衡时,已知H2的转化率为75%,则在该温度下平衡常数Kp=$\frac{100{P}^{2}}{3}$(用平衡分压代替平衡浓度计算,
分压=总压×物质的量分数).
②如果该容器为恒容容器,达到平衡时,H2的转化率<(填“>”、“<”或“=”)75%,理由是恒容容器中,达到平衡时体系压强比恒压容器中小.
(3)在2.0L密闭容器中放入1molCO2(g)和1molH2(g),在一定温度下发生反应Ⅱ的反应,2小时后达到平衡.下表为c(CO2)与反应时间的数据:
40min时,用CO2表示的该反应速率为0.008mol/L•min,分析该反应过程中c(CO2)变化与时间间隔(△t)的规律,得出的结论是随时间增加,二氧化碳浓度减少,反应速率减小.
 利用合成气(主要成分为CO、CO2和H2)合成甲醇,发生的主要反应如下:
利用合成气(主要成分为CO、CO2和H2)合成甲醇,发生的主要反应如下:Ⅰ.CO(g)+2H2(g)?催化剂CH3OH(g)△H1
Ⅱ.CO2(g)+H2(g)?催化剂CO(g)+H2O(g)△H2
Ⅲ.CO2(g)+3H2(g)?催化剂CH3OH(g)+H2O(g)△H3
(1)上述反应达到平衡时对应的氢气的百分含量分别为a1、a2、a3,它们随温度变化的曲线如图所示.则△H2> (填“>”、“<”或“=”) 0,判断理由是升温平衡向吸热反应方向进行;△H1<△H3(填“>”、“<”或“=”).
(2)在温度T时,向某容器中充入1mol CO2和3mol H2,发生反应Ⅲ的反应.
①如果该容器为恒压容器,维持体系总压强p恒定,达到平衡时,已知H2的转化率为75%,则在该温度下平衡常数Kp=$\frac{100{P}^{2}}{3}$(用平衡分压代替平衡浓度计算,
分压=总压×物质的量分数).
②如果该容器为恒容容器,达到平衡时,H2的转化率<(填“>”、“<”或“=”)75%,理由是恒容容器中,达到平衡时体系压强比恒压容器中小.
(3)在2.0L密闭容器中放入1molCO2(g)和1molH2(g),在一定温度下发生反应Ⅱ的反应,2小时后达到平衡.下表为c(CO2)与反应时间的数据:
| 反应时间t/min | 20 | 40 | 60 | 80 |
| c(CO2)(mol/L) | 0.300 | 0.180 | 0.109 | 0.066 |
14.关于具有相同的电子层结构的短周期元素aA2+、bB+、cC3+、dD-,下列说法中正确的是( )
| A. | 原子半径C>A>B>D | B. | 价电子数D>C>A>B | ||
| C. | 离子半径C3+>D->B+>A2+ | D. | 单质的还原性A>B>C>D |
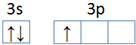 ,第一电离能:镁大于(填“大于”或“小于”)铝.
,第一电离能:镁大于(填“大于”或“小于”)铝.