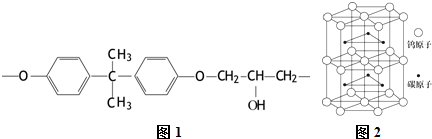
��Ŀ����
19����֪���ֶ�����Ԫ��A��B��C��D��ԭ������������������AԪ�ص�ԭ��ֻ��һ�����Ӳ㣬��֪A��C��B��D�ֱ���ͬһ�����Ԫ�أ�B��D��Ԫ��ԭ�ӵ�������֮����A��C��Ԫ��ԭ�ӵ�������֮�͵Ķ�������֪����Ԫ�صĵ��ʳ��³�ѹ�����������塢���ֹ��壮��ش��������⣺��1��DԪ�������ڱ��е�λ�õ������ڢ�A�壬��A��B����Ԫ�ؿ��γ�E��F���ֻ����д������һ�ֻ�����ֽ�������һ�ֻ�����Ļ�ѧ����ʽ��2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2������Ӧ��ĵ���ʽ��
 ����������ѧ��Ϊ��ѡ���룩bc��
����������ѧ��Ϊ��ѡ���룩bc��a�����Ӽ� b�����Թ��ۼ� c���Ǽ��Թ��ۼ�
��2��BԪ�ر�DԪ�صķǽ�����ǿ�������Ǣ٢ۣ�
����Ԫ����ɵĻ�������DԪ��Ϊ���� ��B���ʵ��۷е��D���۷е�� ��B����̬�⻯����ȶ��Ա�D����̬�⻯����ȶ���ǿ
��3����A��B��D����Ԫ���е����ֿɷֱ��γɼס����������ӣ����Ǿ�Ϊ��һ��˫ԭ�Ӻ˵������ӣ��Ҽ���18�����ӣ��Һ���10�����ӣ�������ҷ�Ӧ�����ӷ���ʽΪ��HS-+OH-=S2-+H2O��
��4��д��C��D��Ԫ�ص�����������Ӧ��ˮ������ϡ��Һ�����Ӧ���Ȼ�ѧ����ʽ����֪�˷�Ӧ����1mol H2Oʱ�ų�������Ϊ57.3kJ����2NaOH��aq��+H2SO4��aq��=Na2SO4��aq��+2H2O��l����H=-114.6kJ/mol��
��5����AԪ�صĵ�����BԪ�صĵ��ʿ����Ƴɵ�أ������װ��KOHŨ��Һ���ö�Ķ��Խ����缫����KOH��Һ����M��ͨ��A�ĵ��ʣ�N��ͨ��B�ĵ��ʣ���M���Ǹõ�صĸ�����N���ĵ缫��ӦʽΪ��O2+2H2O+4e-=4OH-��
���� A��B��C��D�����ֶ�����Ԫ�أ����ǵ�ԭ��������������AԪ�ص�ԭ��ֻ��һ�����Ӳ㣬A��Cͬ���壬��AΪHԪ�أ�B��Dͬ���壬�ֱ��ڶ��������ڣ�����������֮������Ϊ11����Ԫ�ص�ԭ�Ӻ���������֮����A��C��Ԫ��ԭ�Ӻ���������֮�͵Ķ�����C������ΪLi������֪CΪNa����B��D������֮��Ϊ��1+11����2=24����B��������Ϊx����D��������Ϊx+8����x+x+8=22�����x=8����BΪOԪ�ء�DΪSԪ�أ���������Ԫ�صĵ��ʳ��³�ѹ�����������塢���ֹ��壬�ݴ˽��
��� �⣺A��B��C��D�����ֶ�����Ԫ�أ����ǵ�ԭ��������������AԪ�ص�ԭ��ֻ��һ�����Ӳ㣬A��Cͬ���壬��AΪHԪ�أ�B��Dͬ���壬�ֱ��ڶ��������ڣ�����������֮������Ϊ11����Ԫ�ص�ԭ�Ӻ���������֮����A��C��Ԫ��ԭ�Ӻ���������֮�͵Ķ�����C������ΪLi������֪CΪNa����B��D������֮��Ϊ��1+11����2=24����B��������Ϊx����D��������Ϊx+8����x+x+8=22�����x=8����BΪOԪ�ء�DΪSԪ�أ���������Ԫ�صĵ��ʳ��³�ѹ�����������塢���ֹ��壮
��1��DΪSԪ�أ��������ڱ��е������ڢ�A�壬��H��O����Ԫ�ؿ��γ�E��F���ֻ��������һ�ֻ�����ֽ�������һ�ֻ����Ӧ��H2O2�ֽ�����H2O��O2���÷�Ӧ����ʽΪ��2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2����H2O2�ĵ���ʽ��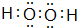 ��������Hԭ����Oԭ��֮���γɼ��Լ�����ԭ��֮���γɷǼ��Լ���
��������Hԭ����Oԭ��֮���γɼ��Լ�����ԭ��֮���γɷǼ��Լ���
�ʴ�Ϊ���������ڢ�A�壻2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2���� ��bc��
��bc��
��2������Ԫ����ɵĻ�������SԪ��Ϊ���ۣ�˵��OԪ�ضԼ��ϵ���������ǿ��OԪ�طǽ�����ǿ���ʢ���ȷ��
�ڵ��ʵ��۷е������������ʣ����ܱȽϽ�����ǿ�����ʢڴ���
����̬�⻯���ȶ�������Ԫ�صķǽ�����Խǿ���ʢ���ȷ��
�ʴ�Ϊ���٢ۣ�
��3����H��O��S����Ԫ���е����ֿɷֱ��γɼס����������ӣ����Ǿ�Ϊ��һ��˫ԭ�Ӻ˵������ӣ��Ҽ���18�����ӣ��Һ���10�����ӣ����ΪHS-����ΪOH-��������ҷ�Ӧ�����ӷ���ʽΪ��HS-+OH-=S2-+H2O��
�ʴ�Ϊ��HS-+OH-=S2-+H2O��
��4������������ϡ���ᷴӦ������������ˮ����֪�˷�Ӧ����1molH2Oʱ�ų�������Ϊ57.3kJ����÷�Ӧ�Ȼ�ѧ����ʽΪ��2NaOH��aq��+H2SO4��aq��=Na2SO4��aq��+2H2O��l����H=-114.6kJ/mol��
�ʴ�Ϊ��2NaOH��aq��+H2SO4��aq��=Na2SO4��aq��+2H2O��l����H=-114.6kJ/mol��
��5���������������Ƴɵ�أ������װ��KOHŨ��Һ���ö�Ľ������Ե缫����KOH��Һ����M��ͨ�������ĵ��ʣ�N��ͨ�������ĵ��ʣ���������������Ӧ����M���Ǹõ�صĸ�����N��������ԭ��Ӧ��������õ��ӣ������������������������缫��ӦʽΪ��O2+2H2O+4e-=4OH-��
�ʴ�Ϊ������O2+2H2O+4e-=4OH-��
���� ���⿼��ṹ����λ�ù�ϵӦ�ã��漰����ʽ���ǽ�����ǿ���Ƚϡ��Ȼ�ѧ����ʽ��ԭ��صȣ��ƶ�Ԫ���ǽ���ؼ���AΪ����Ԫ������һ�����Ӳ�Ϊ�ƶ�ͻ�ƿڣ�ע������ԡ��ǽ�����ǿ���Ƚ�ʵ����ʵ���Ѷ��еȣ�

| A�� | ��������ƽ�������ϸ���һƬ��ͬ��ֽ��Ȼ��NaOH����ֽƬ�Ͻ��г��� | |
| B�� | ������Һʱ������ˮ��������ƿ�̶ȣ�Ӧ�ý�ͷ�ιܽ�������Һ���� | |
| C�� | ������ˮϴ���ձ���������2-3�Σ�ϴ��ҺҲ��������ƿ�� | |
| D�� | ����ʱ��������ƿ�Ŀ̶��ߣ������������Һ���ʵ���Ũ��ƫ�� |
| A�� | ��״���£�22.4L��NO2��CO2��������к��е���ԭ����Ϊ4NA | |
| B�� | �ܱ������У�46gNO2��N2O4�Ļ�������������Ӹ���ΪNA | |
| C�� | ���³�ѹ�£�22.4L��Һ̬ˮ����2.24��10-8NA��OH- | |
| D�� | �����£�16.8 g Fe������ˮ������ȫ��Ӧʧȥ0.8NA������ |
| A�� | ԭ�Ӱ뾶C��A��B��D | B�� | �۵�����D��C��A��B | ||
| C�� | ���Ӱ뾶C3+��D-��B+��A2+ | D�� | ���ʵĻ�ԭ��A��B��C��D |
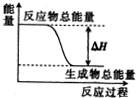
| A�� | ���ȵ�̼�������̼��Ӧ | |
| B�� | ̼��Ƶķֽ� | |
| C�� | Ba��OH��2•8H2O�����NH4Cl������ | |
| D�� | ��������������ת���ɶ�����̼��ˮ |
| A�� | HClO | B�� | HNO3 | C�� | Ca��HCO3��2 | D�� | NaNO3 |
| A�� | 25��ʱ��pH=13��Ba��OH��2��Һ�к��е�OH-��ĿΪ0.1NA | |
| B�� | ��ͭ����ʱ����������������6.4 gʱ����·��ת�Ƶĵ�����һ������0.2NA | |
| C�� | ��0.2 mol H2SO4��Ũ����������ͭ��Ӧ������SO2�ķ�����Ϊ0.1NA | |
| D�� | 200 mL 0.5 mol•L-1 Na2CO3��Һ�У�����CO32-ˮ�⣬���������ӵ���ĿС��0.1NA |
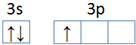 ����һ�����ܣ�þ���ڣ�����ڡ���С�ڡ�������
����һ�����ܣ�þ���ڣ�����ڡ���С�ڡ�������