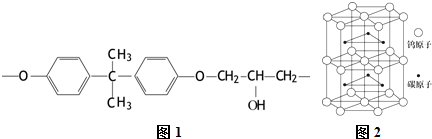
题目内容
15.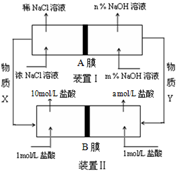 将氯碱工业与燃料电池联合能够有效降低能源消耗,如图是该工艺的图示(电源及电极未标出),则下列说法错误的是( )
将氯碱工业与燃料电池联合能够有效降低能源消耗,如图是该工艺的图示(电源及电极未标出),则下列说法错误的是( )| A. | 装置I为电解池,装置II为原电池 | |
| B. | 物质X为氯气,物质Y为氢气 | |
| C. | A膜为阳离子交换膜,B膜为阴离子交换膜 | |
| D. | 装置Ⅰ中,m小于n,装置II中a等于1 |
分析 装置I由氯化钠溶液得到氢氧化钠,为电解食盐水,X为氯气,Y为氢气,装置Ⅱ为燃料电池,电解池浓氯化钠溶液得到稀氯化钠溶液,则A膜为阳离子交换膜,钠离子进入阴极,装置Ⅱ为燃料电池,负极发生Cl2+2e-=2Cl-,正极发生H2-2e-=2H+,H+从负极经阳离子膜移动到正极,左侧盐酸浓度增大,B膜为阳离子交换膜,以此解答该题.
解答 解:A.装置I由氯化钠溶液得到氢氧化钠,为电解食盐水,X为氯气,Y为氢气,装置Ⅱ为燃料电池,故A正确;
B.可知装置I左侧为阳极,右侧为阴极,则物质X为氯气,物质Y为氢气,故B正确;
C.电解池浓氯化钠溶液得到稀氯化钠溶液,则A膜为阳离子交换膜,钠离子进入阴极,装置Ⅱ为燃料电池,负极发生Cl2+2e-=2Cl-,正极发生H2-2e-=2H+,H+从负极经阳离子膜移动到正极,左侧盐酸浓度增大,B膜为阳离子交换膜,故C错误;
D.装置Ⅰ中,钠离子进入阴极,氢氧化钠浓度增大,m小于n,装置II中a等于1,氯离子浓度不变,则盐酸浓度不变,故D正确.
故选C.
点评 本题考查电解原理与原电池应用,关键是从电解质溶液判断I为电解池、Ⅱ为燃料电池,理解掌握原电池与电解工作原理,题目难度中等.

练习册系列答案
相关题目
5.下列离子方程式书写正确的是( )
| A. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | Cu与稀硝酸的反应 3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | CaCO3与盐酸反应 CO32-+2H+═CO2↑+H2O | |
| D. | 实验室用浓盐酸和二氧化锰反应 MnO2+2H++2Cl-═Mn2++Cl2↑+H2O |
6.常温下,下列说法正确的是( )
| A. | 分别中和pH相同的等体积的盐酸和醋酸溶液,消耗等量的NaOH | |
| B. | pH=a的CH3COOH溶液加水稀释10n倍后,pH=a+n | |
| C. | pH相等的CH3COONa、NaOH溶液中,水的电离程度相同 | |
| D. | Na2CO3溶液中:c(OH-)=c(H+)+c(HCO${\;}_{3}^{-}$)+2c(H2CO3) |
20.分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是( )
| A. | 冰醋酸、纯碱、铜绿、生石灰分别属于酸、碱、盐、氧化物 | |
| B. | HClO、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸 | |
| C. | Al、Al2O3、Al(OH)3均既能与盐酸反应又能与氢氧化钠反应,都属于两性化合物 | |
| D. | H2SO4、NaOH、AlCl3均为强电解质,都属于离子化合物 |
7.设NA为阿伏加德罗常数的值.下列说法中,正确的是( )
| A. | 标准状况下,22.4L的NO2和CO2混合气体中含有的氧原子数为4NA | |
| B. | 密闭容器中,46gNO2和N2O4的混合气体所含分子个数为NA | |
| C. | 常温常压下,22.4L的液态水含有2.24×10-8NA个OH- | |
| D. | 高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子 |
4.下列各物质间的反应,其能量变化符合右图的是( )
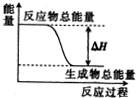

| A. | 灼热的碳与二氧化碳反应 | |
| B. | 碳酸钙的分解 | |
| C. | Ba(OH)2•8H2O晶体和NH4Cl晶体混合 | |
| D. | 葡萄糖在人体中转化成二氧化碳和水 |
8.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1mol苯乙烯(C6H5CH=CH2)中含有的碳碳双键数目为4NA | |
| B. | 加热条件下,MnO2与浓盐酸反应生成7.1gCl2,转移的电子数目为0.2NA | |
| C. | 标准状况下,11.2LCCl4中含有的分子数目为0.5NA | |
| D. | 常温下,1L0.1mol•L-1的CH3COOH溶液中含有的H+数目为0.1NA |

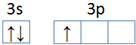 ,第一电离能:镁大于(填“大于”或“小于”)铝.
,第一电离能:镁大于(填“大于”或“小于”)铝.