题目内容
2molA与2molB混合于2L的密闭容器中,发生如下反应:2A(g)+3B(g)2C(g)+zD(g),若2s后,A的转化率为50%,测得v(D)=0.25mol?L-1?s-1,下列推断正确的是( )
| A、v(C)=v(A)=0.2 mol?L-1?s-1 |
| B、z=3 |
| C、B的转化率为75% |
| D、反应前与2 s后容器的压强比为4:3 |
考点:化学平衡的计算
专题:化学平衡专题
分析:2s后A的转化率为50%,则反应的A为2mol×50%=1mol,则
2A(g)+3B(g)?2C(g)+zD(g),
开始量(mol) 2 2 0 0
转化量(mol) 1 1.5 1 0.5z
2s 量(mol) 1 0.5 1 0.5z
v(D)=
0.25mol?L-1?s-1,z=2
结合反应速率之比等于化学计量数之比及转化率的概念,气体压强之比等于气体物质的量之比来解答.
2A(g)+3B(g)?2C(g)+zD(g),
开始量(mol) 2 2 0 0
转化量(mol) 1 1.5 1 0.5z
2s 量(mol) 1 0.5 1 0.5z
v(D)=
| ||
| 2s |
结合反应速率之比等于化学计量数之比及转化率的概念,气体压强之比等于气体物质的量之比来解答.
解答:
解:2s后A的转化率为50%,则反应的A为2mol×50%=1mol,则
2A(g)+3B(g)?2C(g)+zD(g),
开始量(mol) 2 2 0 0
转化l量(mol) 1 1.5 1 0.5z
2s 量(mol) 1 0.5 1 0.5z
A.v(C)=
=0.25mol?L-1?s-1=v(A),故A错误;
B.因反应速率之比等于化学计量数之比,由A可知,z=2,故B错误;
C.B的转化率为
×100%=75%,故C正确;
D.反应前与2 s后容器的压强比等于气体物质的量之比=4:(1+0.5+1+0.5×2)=4:3.5,故D错误;
故选C.
2A(g)+3B(g)?2C(g)+zD(g),
开始量(mol) 2 2 0 0
转化l量(mol) 1 1.5 1 0.5z
2s 量(mol) 1 0.5 1 0.5z
A.v(C)=
| ||
| 2s |
B.因反应速率之比等于化学计量数之比,由A可知,z=2,故B错误;
C.B的转化率为
| 1.5mol |
| 2mol |
D.反应前与2 s后容器的压强比等于气体物质的量之比=4:(1+0.5+1+0.5×2)=4:3.5,故D错误;
故选C.
点评:本题考查化学平衡的计算,明确化学平衡的三段法计算是解答本题的关键,题目较简单.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下由此可判断这四种金属的活动性顺序是( )
| 实验 装置 |  |  |  |  |
| 部分实 验现象 | a极质量减小,b极质量增大 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流从a极流向d极 |
| A、a>b>c>d |
| B、b>c>d>a |
| C、d>a>b>c |
| D、a>b>d>c |
在密闭容器中进行如下反应:X2(g)+Y2(g)═2Z(g),已知X2、Y2、Z的起始浓度分别为0.2mol/L、0.4mol/L、0.3mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A、X2为0.3mol/L |
| B、Y为0.65mol/L |
| C、Y2为0.2mol/L |
| D、Z为0.7mol/L |
 如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cl-离子核间距为a cm,氯化铯的摩尔质量为M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )
如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cl-离子核间距为a cm,氯化铯的摩尔质量为M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )A、
| ||
B、
| ||
C、
| ||
D、
|
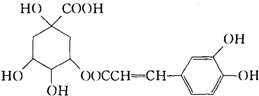 咖啡鞣酸具有较广泛的抗菌作用,其结构简式如图所示:1mol咖啡鞣酸与NaOH完全反应时可消耗 NaOH物质的量是( )
咖啡鞣酸具有较广泛的抗菌作用,其结构简式如图所示:1mol咖啡鞣酸与NaOH完全反应时可消耗 NaOH物质的量是( )| A、2 molNaOH |
| B、4 molNaOH |
| C、6 molNaOH |
| D、8 molNaOH |
 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线: