题目内容
有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下由此可判断这四种金属的活动性顺序是( )
| 实验 装置 |  |  |  |  |
| 部分实 验现象 | a极质量减小,b极质量增大 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流从a极流向d极 |
| A、a>b>c>d |
| B、b>c>d>a |
| C、d>a>b>c |
| D、a>b>d>c |
考点:常见金属的活动性顺序及其应用
专题:
分析:装置一:发生电化学腐蚀,活泼金属作负极,不活泼金属作正极,负极发生氧化反应,负极质量减少;
装置二:发生化学腐蚀,活泼金属与酸反应放出氢气,不活泼金属与酸不反应;
装置三:发生电化学腐蚀,正极有气泡;
装置四:发生电化学腐蚀,氢离子的正极上得电子发生还原反应生成氢气;
装置二:发生化学腐蚀,活泼金属与酸反应放出氢气,不活泼金属与酸不反应;
装置三:发生电化学腐蚀,正极有气泡;
装置四:发生电化学腐蚀,氢离子的正极上得电子发生还原反应生成氢气;
解答:
解:装置一:发生电化学腐蚀,a极质量减小,b极质量增加,a极为负极,b极为正极,所以金属的活动性顺序a>b;
装置二:发生化学腐蚀,b极有气体产生,c极无变化,所以金属的活动性顺序b>c;
装置三:发生电化学腐蚀,d极溶解,所以d是负极,c极有气体产生,所以c是正极,所以金属的活动性顺序d>c;
装置四:发生电化学腐蚀,电流从a极流向d极,a极为正极,d极为负极,所以金属的活动性顺序d>a;
所以这四种金属的活动性顺序d>a>b>c,
故选C.
装置二:发生化学腐蚀,b极有气体产生,c极无变化,所以金属的活动性顺序b>c;
装置三:发生电化学腐蚀,d极溶解,所以d是负极,c极有气体产生,所以c是正极,所以金属的活动性顺序d>c;
装置四:发生电化学腐蚀,电流从a极流向d极,a极为正极,d极为负极,所以金属的活动性顺序d>a;
所以这四种金属的活动性顺序d>a>b>c,
故选C.
点评:本题主要考查了金属的活动性,注意从原电池的角度比较金属性的活动性顺序,注意金属活动性的比较方法的积累,题目难度不大.

练习册系列答案
相关题目
20g密度为dg/cm3的硝酸钙溶液中,含有lgCa2+,则NO3-的物质的量浓度为( )
| A、mol/L |
| B、mol/L |
| C、2.5dmol/L |
| D、1.25dmol/L |
下列实验误差分析错误的是( )
| A、滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 |
| B、用容量瓶配置溶液,定容时俯视刻度线,所配溶液浓度偏小 |
| C、用湿润的pH试纸测稀碱液的pH,测定值偏小 |
| D、测定中和反应反的应热时,将碱液缓慢倒入酸中,所测温度值偏小 |
下列各组分子中,都属于含极性键的非极性分子的是( )
| A、CO2 H2O2 |
| B、C2H4 CH4 |
| C、C60 C2H4 |
| D、NH3 HCl |
某溶液X含有K+、Mg2+、Fe3+、Fe2+、Cl-、CO32-、NO3-、SO42-中的几种,已知该溶液中各离子物质的量浓度均为0.1mol?L-1(不考虑水的电离及离子的水解).为确定该溶液中含有的离子,现进行了如下的操作:下列说法正确的是( )
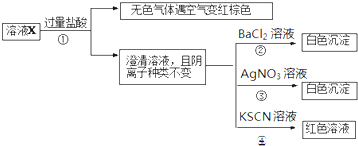

| A、无色气体可能是NO和CO2的混合物 |
| B、由步骤③可以确定原溶液中含有Cl- |
| C、溶液X中所含离子种类共有4种 |
| D、另取l00mL原溶液X,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,理论上得到的固体质量为1.2g |
2molA与2molB混合于2L的密闭容器中,发生如下反应:2A(g)+3B(g)2C(g)+zD(g),若2s后,A的转化率为50%,测得v(D)=0.25mol?L-1?s-1,下列推断正确的是( )
| A、v(C)=v(A)=0.2 mol?L-1?s-1 |
| B、z=3 |
| C、B的转化率为75% |
| D、反应前与2 s后容器的压强比为4:3 |
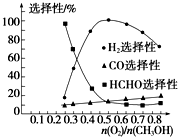
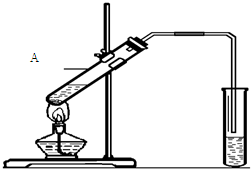 乙酸是食醋的主要成分,它具有以下化学性质:
乙酸是食醋的主要成分,它具有以下化学性质: