题目内容
 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH3CH═CH2+CO+H2
| 一定条件 |
| H2 |
| Ni,△ |
CO的制备原理:HCOOH
| 浓H2So4 |
| △ |
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备氢气、丙烯.写出化学反应方程式:
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液.
考点:制备实验方案的设计
专题:实验题,实验设计题
分析:(1)可用稀盐酸和锌粒反应制备氢气,用2-丙醇在浓硫酸作用下制备丙烯;
(2)若用以上装置制备干燥纯净的CO,生成的CO中含有甲酸、水,可用氢氧化钠除去甲酸,用浓硫酸干燥;
(3)用无水硫酸铜检验水,用品红检验二氧化硫,并用酸性高锰酸钾除去二氧化硫,最后用石灰水检验二氧化碳.
(2)若用以上装置制备干燥纯净的CO,生成的CO中含有甲酸、水,可用氢氧化钠除去甲酸,用浓硫酸干燥;
(3)用无水硫酸铜检验水,用品红检验二氧化硫,并用酸性高锰酸钾除去二氧化硫,最后用石灰水检验二氧化碳.
解答:
解:(1)氢气可用活泼金属锌与非氧化性酸盐酸通过置换反应制备,氧化性酸如硝酸和浓硫酸与锌反应不能产生氢气,方程式为Zn+2HCl=ZnCl2+H2↑;2-丙醇通过消去反应即到达丙烯,方程式为(CH3)2CHOH
CH2=CHCH3↑+H2O,
故答案为:Zn+2HCl=ZnCl2+H2↑;(CH3)2CHOH
CH2=CHCH3↑+H2O;
(2)甲酸在浓硫酸的作用下通过加热脱水即生成CO,由于甲酸易挥发,产生的CO中必然会混有甲酸,所以在收集之前需要除去甲酸,可以利用NaOH溶液吸收甲酸.又因为甲酸易溶于水,所以必需防止液体倒流,即b的作用是防止倒吸,最后通过浓硫酸干燥CO.为了使产生的气体能顺利的从发生装置中排出,就必需保持压强一致,因此a的作用是保持恒压;若用以上装置制备氢气,就不再需要加热,所以此时发生装置中的玻璃仪器名称是分液漏斗和蒸馏烧瓶,
故答案为:恒压;防倒吸; NaOH溶液;浓H2SO4;分液漏斗、蒸馏烧瓶;
(3)检验丙烯可以用酸性KMnO4溶液,检验SO2可以用酸性KMnO4溶液褪色、品红溶液或石灰水,检验CO2可以石灰水,检验水蒸气可以无水CuSO4,所以在检验这四种气体必需考虑试剂的选择和顺序.只要通过溶液,就会产生水蒸气,因此先检验水蒸气;然后检验SO2并在检验之后除去SO2,除SO2可以用饱和Na2SO3溶液,最后检验CO2和丙烯,因此顺序为④⑤①②③(或④⑤①③②),
故答案为:④⑤①②③(或④⑤①③②).
| 浓硫酸 |
| △ |
故答案为:Zn+2HCl=ZnCl2+H2↑;(CH3)2CHOH
| 浓硫酸 |
| △ |
(2)甲酸在浓硫酸的作用下通过加热脱水即生成CO,由于甲酸易挥发,产生的CO中必然会混有甲酸,所以在收集之前需要除去甲酸,可以利用NaOH溶液吸收甲酸.又因为甲酸易溶于水,所以必需防止液体倒流,即b的作用是防止倒吸,最后通过浓硫酸干燥CO.为了使产生的气体能顺利的从发生装置中排出,就必需保持压强一致,因此a的作用是保持恒压;若用以上装置制备氢气,就不再需要加热,所以此时发生装置中的玻璃仪器名称是分液漏斗和蒸馏烧瓶,
故答案为:恒压;防倒吸; NaOH溶液;浓H2SO4;分液漏斗、蒸馏烧瓶;
(3)检验丙烯可以用酸性KMnO4溶液,检验SO2可以用酸性KMnO4溶液褪色、品红溶液或石灰水,检验CO2可以石灰水,检验水蒸气可以无水CuSO4,所以在检验这四种气体必需考虑试剂的选择和顺序.只要通过溶液,就会产生水蒸气,因此先检验水蒸气;然后检验SO2并在检验之后除去SO2,除SO2可以用饱和Na2SO3溶液,最后检验CO2和丙烯,因此顺序为④⑤①②③(或④⑤①③②),
故答案为:④⑤①②③(或④⑤①③②).
点评:本题考查有机物合成方案的设计,题目难度较大,综合性较强,答题时注意把握物质的分离、提纯方法,把握物质的性质的异同是解答该题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
金属铜制取硝酸铜,从节约原料和防止环境污染考虑,最好的方法是( )
A、铜
| ||||
B、铜
| ||||
C、铜
| ||||
D、铜
|
下列各组分子中,都属于含极性键的非极性分子的是( )
| A、CO2 H2O2 |
| B、C2H4 CH4 |
| C、C60 C2H4 |
| D、NH3 HCl |
某溶液X含有K+、Mg2+、Fe3+、Fe2+、Cl-、CO32-、NO3-、SO42-中的几种,已知该溶液中各离子物质的量浓度均为0.1mol?L-1(不考虑水的电离及离子的水解).为确定该溶液中含有的离子,现进行了如下的操作:下列说法正确的是( )
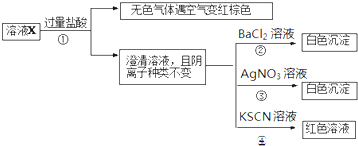

| A、无色气体可能是NO和CO2的混合物 |
| B、由步骤③可以确定原溶液中含有Cl- |
| C、溶液X中所含离子种类共有4种 |
| D、另取l00mL原溶液X,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,理论上得到的固体质量为1.2g |
2molA与2molB混合于2L的密闭容器中,发生如下反应:2A(g)+3B(g)2C(g)+zD(g),若2s后,A的转化率为50%,测得v(D)=0.25mol?L-1?s-1,下列推断正确的是( )
| A、v(C)=v(A)=0.2 mol?L-1?s-1 |
| B、z=3 |
| C、B的转化率为75% |
| D、反应前与2 s后容器的压强比为4:3 |

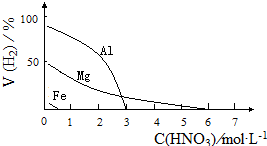 HNO3是一种氧化性的强酸,与金属反应情况多种多样.为探究HNO3性质,某兴趣小组作如下探究:
HNO3是一种氧化性的强酸,与金属反应情况多种多样.为探究HNO3性质,某兴趣小组作如下探究: