题目内容
金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝.高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:WO3 (s)+3H2 (g)
W (s)+3H2O (g)
请回答下列问题:
(1)上述反应的化学平衡常数表达式为 .
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为 ;随温度的升高,H2与水蒸气的体积比减小,则该反应为 反应(填“吸热”或“放热”).
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如表所示:
第一阶段反应的化学方程式为 ;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为 .
| 高温 |
请回答下列问题:
(1)上述反应的化学平衡常数表达式为
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如表所示:
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
考点:化学平衡的计算
专题:化学平衡专题
分析:(1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写,注意固体、纯液体不需要写出;
(2)由反应方程式知,消耗的H2与生成的水的物质的量相等,假定H2与水蒸气的物质的量分别为2mol、3mol,再根据转化率定义计算;
随温度的升高,H2与水蒸气的体积比减小,说明平衡向正反应移动,据此判断;
(3)由表中主要成分与温度关系可知,第一阶段反应为WO3与H2反应是W2O5,同时还生成H2O,配平书写方程式;
580℃时,温度介于550℃~600℃,固体为W2O5、WO2的混合物;
根据三个阶段的方程式进行计算三个阶段消耗H2物质的量之比.
(2)由反应方程式知,消耗的H2与生成的水的物质的量相等,假定H2与水蒸气的物质的量分别为2mol、3mol,再根据转化率定义计算;
随温度的升高,H2与水蒸气的体积比减小,说明平衡向正反应移动,据此判断;
(3)由表中主要成分与温度关系可知,第一阶段反应为WO3与H2反应是W2O5,同时还生成H2O,配平书写方程式;
580℃时,温度介于550℃~600℃,固体为W2O5、WO2的混合物;
根据三个阶段的方程式进行计算三个阶段消耗H2物质的量之比.
解答:
解:(1)WO3(s)+3H2(g)
W(s)+3H2O(g)的平衡常数k=
,故答案为:
;
(2)由反应方程式知,消耗的H2与生成的水的物质的量相等,故H2的平衡转化率为
×100%=60%,
升高温度,H2与水蒸气的体积比减小,说明升温时平衡向右移动,故正反应为吸热反应,
故答案为:60%;吸热;
(3)由表中主要成分与温度关系可知,第一阶段反应为WO3与H2反应是W2O5,同时还生成H2O,反应方程式为2WO3+H2
W2O5+H2O,580℃时,温度介于550℃~600℃,固体为W2O5、WO2的混合物;
假定有2molWO3,由2WO3+H2
W2O5+H2O、W2O5+H2?
2WO2+H2O、WO2+2H2?
W+2H2O可知,三个阶段消耗的氢气的物质的量之比为1mol:1mol:2mol×2=1:1:4,
故答案为:2WO3+H2
W2O5+H2O;1:1:4.
| ||
| c3(H2O) |
| c3(H2) |
| c3(H2O) |
| c3(H2) |
(2)由反应方程式知,消耗的H2与生成的水的物质的量相等,故H2的平衡转化率为
| 3mol |
| 2mol+3mol |
升高温度,H2与水蒸气的体积比减小,说明升温时平衡向右移动,故正反应为吸热反应,
故答案为:60%;吸热;
(3)由表中主要成分与温度关系可知,第一阶段反应为WO3与H2反应是W2O5,同时还生成H2O,反应方程式为2WO3+H2
| ||
假定有2molWO3,由2WO3+H2
| ||
| ||
| ||
故答案为:2WO3+H2
| ||
点评:本题考查化学平衡常数的书写、化学平衡移动原理、化学平衡计算等,题目选择的素材比较陌生,以考查学生的能力为主,难度中等.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
关于居室内空气污染的说法错误的是( )
| A、居室内空气中存在的污染物主要来自于装修材料、日用化学品、香烟烟雾以及家用燃料的燃烧产物等 |
| B、燃料不完全燃烧产生的一氧化碳也是一种室内污染物 |
| C、在居室内放置几盒花草就可消除室内空气污染 |
| D、预防装修污染,最重要的是选择经过严格检测的、环保的装修材料 |
下列实验误差分析错误的是( )
| A、滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 |
| B、用容量瓶配置溶液,定容时俯视刻度线,所配溶液浓度偏小 |
| C、用湿润的pH试纸测稀碱液的pH,测定值偏小 |
| D、测定中和反应反的应热时,将碱液缓慢倒入酸中,所测温度值偏小 |
某溶液X含有K+、Mg2+、Fe3+、Fe2+、Cl-、CO32-、NO3-、SO42-中的几种,已知该溶液中各离子物质的量浓度均为0.1mol?L-1(不考虑水的电离及离子的水解).为确定该溶液中含有的离子,现进行了如下的操作:下列说法正确的是( )
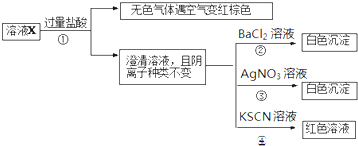

| A、无色气体可能是NO和CO2的混合物 |
| B、由步骤③可以确定原溶液中含有Cl- |
| C、溶液X中所含离子种类共有4种 |
| D、另取l00mL原溶液X,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,理论上得到的固体质量为1.2g |
2molA与2molB混合于2L的密闭容器中,发生如下反应:2A(g)+3B(g)2C(g)+zD(g),若2s后,A的转化率为50%,测得v(D)=0.25mol?L-1?s-1,下列推断正确的是( )
| A、v(C)=v(A)=0.2 mol?L-1?s-1 |
| B、z=3 |
| C、B的转化率为75% |
| D、反应前与2 s后容器的压强比为4:3 |
下列四组实验,根据实验事实得出的结论,正确的是( )
| A、在某试液中滴加BaCl2溶液得白色沉淀,取该白色沉淀加稀硝酸不溶解,则原未知试液中一定含有S042- |
| B、在某试液中滴加NaOH溶液得白色沉淀,继续滴加该白色沉淀溶解,则原未知试液中一定含有Al3+ |
| C、在未知试液中滴加盐酸产生无色气体,将该气体通入过量澄清石灰水中得白色沉淀,则原未知试液中一定含有C032- |
| D、某未知气体通入品红溶液中,品红溶液褪色,则原气体一定是S02 |

