题目内容
在密闭容器中进行如下反应:X2(g)+Y2(g)═2Z(g),已知X2、Y2、Z的起始浓度分别为0.2mol/L、0.4mol/L、0.3mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A、X2为0.3mol/L |
| B、Y为0.65mol/L |
| C、Y2为0.2mol/L |
| D、Z为0.7mol/L |
考点:化学反应的可逆性,化学平衡的计算
专题:化学平衡专题
分析:化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,全部转到一边,求算各物质浓度的取值范围,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析.
可逆反应的特点:反应不能进行到底.可逆反应无论进行多长时间,反应物不可能100%地全部转化为生成物.
可逆反应的特点:反应不能进行到底.可逆反应无论进行多长时间,反应物不可能100%地全部转化为生成物.
解答:
解:若反应向正反应进行到达平衡,X2、Y2的浓度最小,Z的浓度最大,假定完全反应,则:
根据方程式 X2(气)+Y2(气)?2Z(气),
开始(mol/L):0.2 0.4 0.3
变化(mol/L):0.2 0.2 0.4
平衡(mol/L):0 0.2 0.7
若反应向逆反应进行到达平衡,X2、Y2的浓度最大,Z的浓度最小,假定完全反应,则:
根据方程式 X2(气)+Y2(气)?2Z(气),
开始(mol/L):0.2 0.4 0.3
变化(mol/L):0.15 0.15 0.3
平衡(mol/L):0.35 0.55 0
由于为可能反应,物质不能完全转化所以平衡时浓度范围为0<c(X2)0.35,0.2<c(Y2)<0.55,0<c(Z)<0.7,
故A正确、BCD错误.
故选:A.
根据方程式 X2(气)+Y2(气)?2Z(气),
开始(mol/L):0.2 0.4 0.3
变化(mol/L):0.2 0.2 0.4
平衡(mol/L):0 0.2 0.7
若反应向逆反应进行到达平衡,X2、Y2的浓度最大,Z的浓度最小,假定完全反应,则:
根据方程式 X2(气)+Y2(气)?2Z(气),
开始(mol/L):0.2 0.4 0.3
变化(mol/L):0.15 0.15 0.3
平衡(mol/L):0.35 0.55 0
由于为可能反应,物质不能完全转化所以平衡时浓度范围为0<c(X2)0.35,0.2<c(Y2)<0.55,0<c(Z)<0.7,
故A正确、BCD错误.
故选:A.
点评:本题考查了化学平衡的建立,难度不大,关键是利用可逆反应的不完全性,运用极限假设法解答,假设法是解化学习题的常用方法.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
| A、X与Y形成的化合物中,X可以显负价,Y显正价 |
| B、最高正化合价:X大于Y |
| C、第一电离能可能Y小于X |
| D、气态氢化物的稳定性:HmY小于HnX |
下列各组分子中,都属于含极性键的非极性分子的是( )
| A、CO2 H2O2 |
| B、C2H4 CH4 |
| C、C60 C2H4 |
| D、NH3 HCl |
2molA与2molB混合于2L的密闭容器中,发生如下反应:2A(g)+3B(g)2C(g)+zD(g),若2s后,A的转化率为50%,测得v(D)=0.25mol?L-1?s-1,下列推断正确的是( )
| A、v(C)=v(A)=0.2 mol?L-1?s-1 |
| B、z=3 |
| C、B的转化率为75% |
| D、反应前与2 s后容器的压强比为4:3 |
氢化亚铜(CuH)是一难溶物质,用CuSO4溶液和“另一种反应物”在40℃~50℃时反应可生成它.CuH不稳定,易分解;CuH在氯气中能燃烧;跟盐酸反应能产生气体,以下有关它的推断中错误的是( )
| A、“另一种反应物”一定具有氧化性 |
| B、CuH既可做氧化剂也可做还原剂 |
| C、CuH+Cl2═CuCl+HCl↑(燃烧) |
| D、CuH+HCl═CuCl+H2↑(常温) |

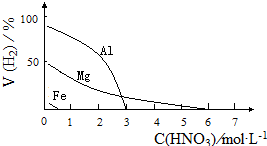 HNO3是一种氧化性的强酸,与金属反应情况多种多样.为探究HNO3性质,某兴趣小组作如下探究:
HNO3是一种氧化性的强酸,与金属反应情况多种多样.为探究HNO3性质,某兴趣小组作如下探究: