题目内容
2. 乙醇、乙酸都是有机化工重要的基础原料.
乙醇、乙酸都是有机化工重要的基础原料.(1)空气中,乙醇蒸气能使红热铜丝保持红热,该反应的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(2)浓硫酸催化下,乙酸和乙醇生成乙酸乙酯
CH3COOH+CH3CH2OH$?_{110-120℃}^{H_{2}SO_{4}}$CH3COOH2CH3+H2O
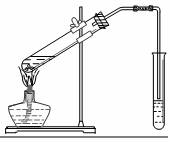
某化学兴趣小组的同学用如图装置进行该酯化反应的探究实验:
①要向大试管中加2mL浓硫酸、3mL乙醇、2mL乙酸,其具体操作是大试管中加入3mL乙醇,然后边振荡试管边加入2mL浓硫酸和2mL乙酸.
②小试管中装的是浓Na2CO3溶液,导气管不插入液面下是为了防止倒吸.
③相关物质的部分性质:
| 乙醇 | 乙酸 | 乙酸乙酯 | |
| 沸点 | 78.0℃ | 117.9℃ | 77.5℃ |
| 水溶性 | 易溶 | 易溶 | 难溶 |
④分离小试管中的乙酸乙酯应使用的仪器名称是分液漏斗;分离时,乙酸乙酯应该从仪器上口倒出(填“下口放”或“上口倒出”).
⑤兴趣小组多次试验后,测出乙醇与乙酸用量和最后得到的乙酸乙酯生成量如表:
| 实验序号 | 乙醇(mL) | 乙酸(mL) | 乙酸乙酯(mL) |
| a | 2 | 2 | 1.33 |
| b | 3 | 2 | 1.57 |
| c | 4 | 2 | X |
| d | 5 | 2 | 1.76 |
| e | 2 | 3 | 1.55 |
分析 (1)乙醇催化氧化生成乙醛;
(2)①混合物先加密度小的,再加密度大的,最后加乙酸,防止乙酸挥发;
②乙酸、乙醇易溶于水,导气管不插入液面下,可防止倒吸;
③用水替代小试管中的Na2CO3溶液,不能分层;
④分液时使用分液漏斗,乙酸乙酯在碳酸钠溶液的上层;
⑤酯化反应为可逆反应,增大乙醇的量,可促进乙酸的转化;实验a、e中乙酸的量不同.
解答 解:(1)空气中,乙醇蒸气能使红热铜丝保持红热,发生催化氧化反应生成乙醛,该反应的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
(2)①要向大试管中加2mL浓硫酸、3mL乙醇、2mL乙酸,其具体操作是大试管中加入3mL乙醇,然后边振荡试管边加入2mL浓硫酸和2mL乙酸,
故答案为:大试管中加入3mL乙醇,然后边振荡试管边加入2mL浓硫酸和2mL乙酸;
②小试管中装的是浓Na2CO3溶液,导气管不插入液面下是为了防止倒吸,故答案为:倒吸;
③不能用水替代小试管中的Na2CO3溶液,理由是乙酸乙酯在乙醇、乙酸和水的混合溶液中溶解度比较大,故答案为:不能,乙酸乙酯在乙醇、乙酸和水的混合溶液中溶解度比较大;
④分离小试管中的乙酸乙酯,利用分液法,应使用的仪器名称是分液漏斗;分离时,乙酸乙酯应该从仪器上口倒出,故答案为:分液漏斗; 上口倒出;
⑤酯化反应为可逆反应,增大乙醇的量,可促进乙酸的转化,则表中数据X的范围是1.57-1.76mL;实验a、e中乙酸的量不同,则实验a与实验e探究的目的是探究乙酸用量对乙酸乙酯产量的影响,故答案为:1.57-1.76mL;探究乙酸用量对乙酸乙酯产量的影响.
点评 本题考查物质的制备实验,为高频考点,把握制备原理、实验技能、有机物的性质、平衡移动为解答的关键,侧重分析与应用能力的考查,注意混合物分离提纯实验的应用,题目难度不大.

| A. | NH3的电子式: | |
| B. | CS2分子的球棍模型: | |
| C. | 二氧化硅的分子式:SiO2 | |
| D. | Mg5(Si4O10)2(OH)2•4H2O的氧化物形式:5MgO•8SiO2•5H2O |
KCl+Na $\stackrel{一定条件}{?}$ NaCl+K+Q (Q<0)
有关数据如下表:
| 熔点℃ | 沸点℃ | 密度(g/cm3) | |
| Na | 97.8 | 882.9 | 0.97 |
| K | 63.7 | 774 | 0.86 |
| NaCl | 801 | 1413 | 2.165 |
| KCl | 770 | 1500(升华) | 1.984 |
(2)在制取金属钾的过程中,为了提高原料的转化率可采取的措施是适当的降低温度或移去钾蒸气.
(3)生产中常向反应物中通入一种气体,并将从反应器中导出的气体进行冷却得到金属钾,且将该气体可循环利用,该气体是d.
a.干燥的空气 b.氮气 c.二氧化碳 d.稀有气体
(4)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为K=$\frac{c(K)}{c(Na)}$.
| A. | 萃取 | B. | 电解 | C. | 净水 | D. | 分馏 |
 2016年8月10日《生物谷》载文称,“毒性气体”CO、NO及H2S可作为新型药物开发的潜在靶点,用以开发更多新型药物来帮助治疗多种人类疾病.下列有关这三种气体的说法正确的是( )
2016年8月10日《生物谷》载文称,“毒性气体”CO、NO及H2S可作为新型药物开发的潜在靶点,用以开发更多新型药物来帮助治疗多种人类疾病.下列有关这三种气体的说法正确的是( )| A. | 都是电解质 | B. | 都易溶于水 | ||
| C. | 都能与碱溶液反应 | D. | 都属于共价化合物 |
I.一定条件下某密闭容器中可发生反应:aX2+bW2?cm,反应过程中物质的浓度变化如下:
| X2 | W2 | m | |
| 起始浓度/mol•L-1 | 0.4 | 0.4 | 0 |
| 平衡浓度/mol•L-1 | 0.3 | 0.1 | 0.2 |
| A. | 原子半径:W<X<Y | B. | a:b:c=3:1:2 | ||
| C. | X的氧化物一定是无色气体 | D. | m、n、p三种物质均为共价化合物 |
| A. | 某无色溶液中可能大量存在H+、Cl-、MnO4- | |
| B. | pH=2的溶液中可能大量存在Na+、NH4+、SiO32- | |
| C. | 冷的氢氧化钠溶液中通入氯气:Cl2+2OH-═ClO-+Cl-+H2O | |
| D. | 稀硫酸和氢氧化钡溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O |



 .
. .
. .
.