题目内容
1.下列关于离子共存或离子反应的说法正确的是( )| A. | 某无色溶液中可能大量存在H+、Cl-、MnO4- | |
| B. | pH=2的溶液中可能大量存在Na+、NH4+、SiO32- | |
| C. | 冷的氢氧化钠溶液中通入氯气:Cl2+2OH-═ClO-+Cl-+H2O | |
| D. | 稀硫酸和氢氧化钡溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
分析 A.高锰酸根离子为紫色;
B.氢离子与硅酸根离子反应;
C.二者反应生成氯化钠和次氯酸钠、水;
D.离子个数配比不符合物质的结构.
解答 解:A.无色溶液中不可能大量存在高锰酸根离子,故A错误;
B.pH=2的溶液,显酸性,可能大量存在Na+、NH4+,H+与SiO32-反应生成硅酸沉淀,不能大量共存,故B错误;
C.冷的氢氧化钠溶液中通入氯气,离子方程式:Cl2+2OH-═ClO-+Cl-+H2O,故C正确;
D.稀硫酸和氢氧化钡溶液反应,离子方程式:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,离子的共存,明确离子反应发生的条件,熟悉物质的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
2.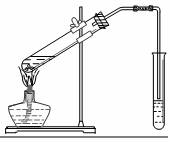 乙醇、乙酸都是有机化工重要的基础原料.
乙醇、乙酸都是有机化工重要的基础原料.
(1)空气中,乙醇蒸气能使红热铜丝保持红热,该反应的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(2)浓硫酸催化下,乙酸和乙醇生成乙酸乙酯
CH3COOH+CH3CH2OH$?_{110-120℃}^{H_{2}SO_{4}}$CH3COOH2CH3+H2O
某化学兴趣小组的同学用如图装置进行该酯化反应的探究实验:
①要向大试管中加2mL浓硫酸、3mL乙醇、2mL乙酸,其具体操作是大试管中加入3mL乙醇,然后边振荡试管边加入2mL浓硫酸和2mL乙酸.
②小试管中装的是浓Na2CO3溶液,导气管不插入液面下是为了防止倒吸.
③相关物质的部分性质:
根据上表数据有同学提出可用水替代小试管中的Na2CO3溶液,你认为可行吗?说明理由:不能,乙酸乙酯在乙醇、乙酸和水的混合溶液中溶解度比较大.
④分离小试管中的乙酸乙酯应使用的仪器名称是分液漏斗;分离时,乙酸乙酯应该从仪器上口倒出(填“下口放”或“上口倒出”).
⑤兴趣小组多次试验后,测出乙醇与乙酸用量和最后得到的乙酸乙酯生成量如表:
表中数据X的范围是1.57-1.76mL;实验a与实验e探究的目的是探究乙酸用量对乙酸乙酯产量的影响.
 乙醇、乙酸都是有机化工重要的基础原料.
乙醇、乙酸都是有机化工重要的基础原料.(1)空气中,乙醇蒸气能使红热铜丝保持红热,该反应的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(2)浓硫酸催化下,乙酸和乙醇生成乙酸乙酯
CH3COOH+CH3CH2OH$?_{110-120℃}^{H_{2}SO_{4}}$CH3COOH2CH3+H2O
某化学兴趣小组的同学用如图装置进行该酯化反应的探究实验:
①要向大试管中加2mL浓硫酸、3mL乙醇、2mL乙酸,其具体操作是大试管中加入3mL乙醇,然后边振荡试管边加入2mL浓硫酸和2mL乙酸.
②小试管中装的是浓Na2CO3溶液,导气管不插入液面下是为了防止倒吸.
③相关物质的部分性质:
| 乙醇 | 乙酸 | 乙酸乙酯 | |
| 沸点 | 78.0℃ | 117.9℃ | 77.5℃ |
| 水溶性 | 易溶 | 易溶 | 难溶 |
④分离小试管中的乙酸乙酯应使用的仪器名称是分液漏斗;分离时,乙酸乙酯应该从仪器上口倒出(填“下口放”或“上口倒出”).
⑤兴趣小组多次试验后,测出乙醇与乙酸用量和最后得到的乙酸乙酯生成量如表:
| 实验序号 | 乙醇(mL) | 乙酸(mL) | 乙酸乙酯(mL) |
| a | 2 | 2 | 1.33 |
| b | 3 | 2 | 1.57 |
| c | 4 | 2 | X |
| d | 5 | 2 | 1.76 |
| e | 2 | 3 | 1.55 |
12.在2L的密闭容器中发生反应xA(g)+yB(g)?zC(g).图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( )


| A. | 200℃时,该反应的平衡常数为25 | |
| B. | 200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol•L-1•min-1 | |
| C. | 200℃时,原平衡中再加入0.4molC,则B的物质的量分数大于25% | |
| D. | 由图乙可知,反应xA(g)+yB(g)?zC(g)的△H<0,且△S<0 |
16.某无色溶液中,先加入足量稀盐酸,无任何变化,再加入BaCl2(aq),产生白色沉淀,则下列说法中正确的是( )
| A. | 无色溶液中一定含有SO42- | |
| B. | 无色溶液中一定含有Ag+ | |
| C. | 无色溶液中一定同时含有SO42-和Ag+ | |
| D. | 无色溶液中可能含有Ag+和SO42-中的一种或两种 |
6.下列说法正确的是( )
| A. | 同时改变两个变量来研究化学平衡的移动,能更快得出有关规律 | |
| B. | 催化剂通过改变反应历程,降低反应的活化能来加快反应速率 | |
| C. | 可逆反应的平衡向正向移动,该反应的平衡常数一定增大 | |
| D. | 安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率 |
13.甲、乙两个恒容密闭容器中均发生反应:C(s)+2H2O(g)?CO2(g)+2H2(g)△H>0,有关数据如表所示.下列说法正确的是( )
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | 平衡时吸收的热量 | |
| C(s) | H2O(g) | H2(g) | |||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 2.5 | Q1 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 | Q2 |
| A. | T1<T2 | |
| B. | Q1>Q2 | |
| C. | 甲容器中,混合气体的密度始终保持不变 | |
| D. | 乙容器中,反应进行到1.5min时,n(H2O)=1.4mol |
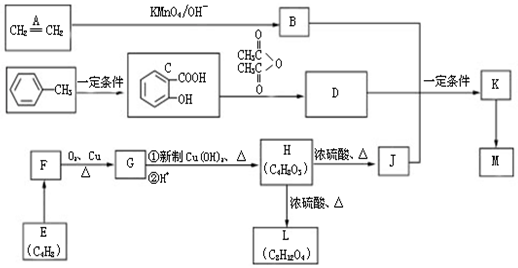

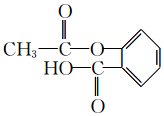 .
.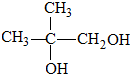 ,H→J的反应类型消去反应.
,H→J的反应类型消去反应. .
.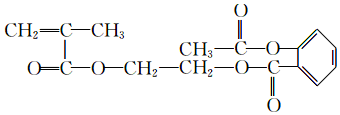 .
. .
. 或
或 或
或 .
.