题目内容
13.工业上生产Na、Ca、Mg都用电解其熔融的氯化物,但钾却不能用电解熔融KCl的方法制得,因金属钾易溶于熔融态的KCl中而有危险,难获得钾,且降低电流效率.现生产钾是用属钠和熔化的KCl在一定的条件下反应制取:KCl+Na $\stackrel{一定条件}{?}$ NaCl+K+Q (Q<0)
有关数据如下表:
| 熔点℃ | 沸点℃ | 密度(g/cm3) | |
| Na | 97.8 | 882.9 | 0.97 |
| K | 63.7 | 774 | 0.86 |
| NaCl | 801 | 1413 | 2.165 |
| KCl | 770 | 1500(升华) | 1.984 |
(2)在制取金属钾的过程中,为了提高原料的转化率可采取的措施是适当的降低温度或移去钾蒸气.
(3)生产中常向反应物中通入一种气体,并将从反应器中导出的气体进行冷却得到金属钾,且将该气体可循环利用,该气体是d.
a.干燥的空气 b.氮气 c.二氧化碳 d.稀有气体
(4)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为K=$\frac{c(K)}{c(Na)}$.
分析 (1)由表格数据可知,K的沸点低,为774℃;反应时保证Na不能转化为气体;
(2)为了提高原料的转化率,可使平衡正向移动;
(3)从反应器中导出的气体进行冷却得到金属钾,且将该气体可循环利用,该气体性质稳定,不能与Na、K反应;
(4)当反应温度升高到900℃时,Na、K均为气体,结合K为生成物浓度幂之积与反应物浓度幂之积的比解答.
解答 解:(1)工业上制取金属钾的化学原理是化学平衡移动原理(勒夏特列原理/钾蒸汽逸出使生成物浓度减小,平衡向正反应方向移动,可不断得到金属钾),在常压下金属钾转为气态从反应混合物中分离的最低温度约为774℃,而反应的最高温度应低于882.9℃,
故答案为:化学平衡移动原理(勒夏特列原理/钾蒸汽逸出使生成物浓度减小,平衡向正反应方向移动,可不断得到金属钾);774℃;882.9℃;
(2)在制取金属钾的过程中,为了提高原料的转化率可采取的措施是适当的降低温度或移去钾蒸气,
故答案为:当的降低温度或移去钾蒸气;
(3)从反应器中导出的气体进行冷却得到金属钾,且将该气体可循环利用,该气体性质稳定,不能与Na、K反应,只有稀有气体符合,故答案为:d;
(4)当反应温度升高到900℃时,只有Na、K为气体,K=$\frac{c(K)}{c(Na)}$,故答案为:K=$\frac{c(K)}{c(Na)}$.
点评 本题考查化学平衡常数K的意义及平衡移动,为高频考点,把握K与反应的关系、状态与表格中温度的关系为解答的关键,侧重分析与应用能力的考查,注意平衡移动原理的应用,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.下列有关实验操作的叙述错误的是( )
| A. | 过滤操作中,玻璃棒应适时搅拌漏斗器 | |
| B. | 蒸发时,不能把蒸发皿放置于石棉网上加热 | |
| C. | 萃取分液时,将塞上凹槽或小孔对准漏斗上小孔,然后打开活塞才能放出下层液体 | |
| D. | 配制容量瓶,定容时改用胶头滴管滴加蒸馏水 |
8.已知C3N4晶体具有比金刚石还大的硬度,且原子间均以单键结合.下列关于C3N4 晶体的说法正确的是( )
| A. | C3N4 晶体是分子晶体 | |
| B. | C3N4 晶体中微粒间通过离子键结合 | |
| C. | C3N4 晶体中C-N键的键长比金刚石中C-C键的键长要长 | |
| D. | C3N4 晶体中每个C原子连接4个N 原子,而每个N原子连接3个C原子 |
18.已知:热化学方程式:
Zn(s)+$\frac{1}{2}$O2(g)═ZnO(s)△H=-351.1kJ•mol-1
2Hg(l)+O2(g)═2HgO(s)△H=-181.4kJ•mol-1
由此可知Zn(s)+HgO(s)═ZnO(s)+Hg(l)△H=____( )
Zn(s)+$\frac{1}{2}$O2(g)═ZnO(s)△H=-351.1kJ•mol-1
2Hg(l)+O2(g)═2HgO(s)△H=-181.4kJ•mol-1
由此可知Zn(s)+HgO(s)═ZnO(s)+Hg(l)△H=____( )
| A. | -441.8kJ•mol-1 | B. | -254.8kJ•mol-1 | C. | -438.9kJ•mol-1 | D. | -260.4kJ•mol-1 |
5.下列说法正确的是( )
| A. | 水晶、玛瑙、红宝石、蓝宝石的主要成分都是非金属氧化物 | |
| B. | 蛋白质是结构复杂的高分子化合物,蛋白质的生物活性首先取决于蛋白质的一级结构 | |
| C. | 同位素示踪法是研究化学反应历程的手段之一,红外光谱法可用于研究有机物分子结构,滴定法不能用于测量盐类物质溶液的浓度 | |
| D. | 丁达尔现象可用于区别溶液与胶体,云、雾、稀硫酸均能产生丁达尔现象 |
2. 乙醇、乙酸都是有机化工重要的基础原料.
乙醇、乙酸都是有机化工重要的基础原料.
(1)空气中,乙醇蒸气能使红热铜丝保持红热,该反应的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(2)浓硫酸催化下,乙酸和乙醇生成乙酸乙酯
CH3COOH+CH3CH2OH$?_{110-120℃}^{H_{2}SO_{4}}$CH3COOH2CH3+H2O
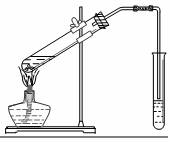
某化学兴趣小组的同学用如图装置进行该酯化反应的探究实验:
①要向大试管中加2mL浓硫酸、3mL乙醇、2mL乙酸,其具体操作是大试管中加入3mL乙醇,然后边振荡试管边加入2mL浓硫酸和2mL乙酸.
②小试管中装的是浓Na2CO3溶液,导气管不插入液面下是为了防止倒吸.
③相关物质的部分性质:
根据上表数据有同学提出可用水替代小试管中的Na2CO3溶液,你认为可行吗?说明理由:不能,乙酸乙酯在乙醇、乙酸和水的混合溶液中溶解度比较大.
④分离小试管中的乙酸乙酯应使用的仪器名称是分液漏斗;分离时,乙酸乙酯应该从仪器上口倒出(填“下口放”或“上口倒出”).
⑤兴趣小组多次试验后,测出乙醇与乙酸用量和最后得到的乙酸乙酯生成量如表:
表中数据X的范围是1.57-1.76mL;实验a与实验e探究的目的是探究乙酸用量对乙酸乙酯产量的影响.
 乙醇、乙酸都是有机化工重要的基础原料.
乙醇、乙酸都是有机化工重要的基础原料.(1)空气中,乙醇蒸气能使红热铜丝保持红热,该反应的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(2)浓硫酸催化下,乙酸和乙醇生成乙酸乙酯
CH3COOH+CH3CH2OH$?_{110-120℃}^{H_{2}SO_{4}}$CH3COOH2CH3+H2O
某化学兴趣小组的同学用如图装置进行该酯化反应的探究实验:
①要向大试管中加2mL浓硫酸、3mL乙醇、2mL乙酸,其具体操作是大试管中加入3mL乙醇,然后边振荡试管边加入2mL浓硫酸和2mL乙酸.
②小试管中装的是浓Na2CO3溶液,导气管不插入液面下是为了防止倒吸.
③相关物质的部分性质:
| 乙醇 | 乙酸 | 乙酸乙酯 | |
| 沸点 | 78.0℃ | 117.9℃ | 77.5℃ |
| 水溶性 | 易溶 | 易溶 | 难溶 |
④分离小试管中的乙酸乙酯应使用的仪器名称是分液漏斗;分离时,乙酸乙酯应该从仪器上口倒出(填“下口放”或“上口倒出”).
⑤兴趣小组多次试验后,测出乙醇与乙酸用量和最后得到的乙酸乙酯生成量如表:
| 实验序号 | 乙醇(mL) | 乙酸(mL) | 乙酸乙酯(mL) |
| a | 2 | 2 | 1.33 |
| b | 3 | 2 | 1.57 |
| c | 4 | 2 | X |
| d | 5 | 2 | 1.76 |
| e | 2 | 3 | 1.55 |
12.在2L的密闭容器中发生反应xA(g)+yB(g)?zC(g).图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( )


| A. | 200℃时,该反应的平衡常数为25 | |
| B. | 200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol•L-1•min-1 | |
| C. | 200℃时,原平衡中再加入0.4molC,则B的物质的量分数大于25% | |
| D. | 由图乙可知,反应xA(g)+yB(g)?zC(g)的△H<0,且△S<0 |