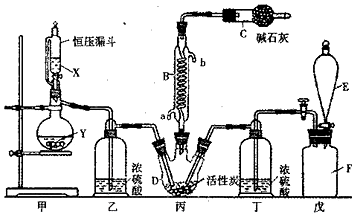
题目内容
11.二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45s时,达到平衡(NO2浓度约为0.0125mol/L).图中的曲线表示二氧化氮分解反应在前25s内的反应进程.(1)前20秒内O2的平均生成速率:5.5×10-4mol/(L•s)
(2)在某温度下达到平衡后,不改变其他条件,向该容器中再加入少量的NO2,平衡移动的方向是正向,NO2的平衡转化率< 68.75%(填“>”、“<”或“=”),NO的体积百分含量减小 (填“增大”、“减小”或“不变”)
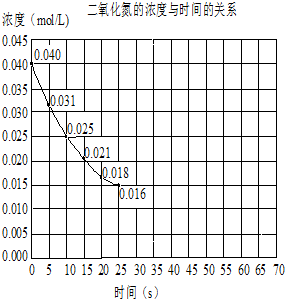
分析 (1)由图可知,20秒内NO2的浓度变化为0.04mol/L-0.018mol/L=0.022mol/L,根据v=$\frac{△c}{△t}$计算v(NO2),再利用速率之比等于化学计量数之比计算v(O2);
(2)在某温度下达到平衡后,不改变其他条件,向该容器中再加入少量的NO2,二氧化氮浓度增大,平衡正向移动,但二氧化氮转化的增加量小于加入的增加量,NO的物质的量增大,但NO物质的量增大量小于容器中增加的物质的量.
解答 解:(1)由图可知,20秒内NO2的浓度变化为0.04mol/L-0.018mol/L=0.022mol/L,故v(NO2)$\frac{0.022mol/L}{20s}$=0.0011mol/(L•s),对于2NO2?2NO+O2,速率之比等于化学计量数之比,所以v(O2)=$\frac{1}{2}$v(NO2)=$\frac{1}{2}$×0.0011mol/(L•s)=5.5×10-4mol/(L•s),
故答案为:5.5×10-4;
(2)在某温度下达到平衡后,不改变其他条件,向该容器中再加入少量的NO2,二氧化氮浓度增大,平衡正向移动,但二氧化氮转化的增加量小于加入的增加量,所以二氧化氮转化率降低,小于68.75%,NO的物质的量增大,但NO物质的量增大量小于容器中增加的物质的量,所以NO的体积百分含量减小,
故答案为:正向;<;减小.
点评 本题考查化学平衡计算及化学平衡影响因素,为高频考点,侧重考查学生分析判断能力,注意:当反应物的物质的量之比等于其计量数之比时反应物的转化率最大,平衡后加入一种气体另一种气体的转化率增大,但其本身的转化率减小,为易错点.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目
2. 乙醇、乙酸都是有机化工重要的基础原料.
乙醇、乙酸都是有机化工重要的基础原料.
(1)空气中,乙醇蒸气能使红热铜丝保持红热,该反应的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(2)浓硫酸催化下,乙酸和乙醇生成乙酸乙酯
CH3COOH+CH3CH2OH$?_{110-120℃}^{H_{2}SO_{4}}$CH3COOH2CH3+H2O
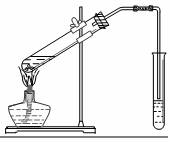
某化学兴趣小组的同学用如图装置进行该酯化反应的探究实验:
①要向大试管中加2mL浓硫酸、3mL乙醇、2mL乙酸,其具体操作是大试管中加入3mL乙醇,然后边振荡试管边加入2mL浓硫酸和2mL乙酸.
②小试管中装的是浓Na2CO3溶液,导气管不插入液面下是为了防止倒吸.
③相关物质的部分性质:
根据上表数据有同学提出可用水替代小试管中的Na2CO3溶液,你认为可行吗?说明理由:不能,乙酸乙酯在乙醇、乙酸和水的混合溶液中溶解度比较大.
④分离小试管中的乙酸乙酯应使用的仪器名称是分液漏斗;分离时,乙酸乙酯应该从仪器上口倒出(填“下口放”或“上口倒出”).
⑤兴趣小组多次试验后,测出乙醇与乙酸用量和最后得到的乙酸乙酯生成量如表:
表中数据X的范围是1.57-1.76mL;实验a与实验e探究的目的是探究乙酸用量对乙酸乙酯产量的影响.
 乙醇、乙酸都是有机化工重要的基础原料.
乙醇、乙酸都是有机化工重要的基础原料.(1)空气中,乙醇蒸气能使红热铜丝保持红热,该反应的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(2)浓硫酸催化下,乙酸和乙醇生成乙酸乙酯
CH3COOH+CH3CH2OH$?_{110-120℃}^{H_{2}SO_{4}}$CH3COOH2CH3+H2O
某化学兴趣小组的同学用如图装置进行该酯化反应的探究实验:
①要向大试管中加2mL浓硫酸、3mL乙醇、2mL乙酸,其具体操作是大试管中加入3mL乙醇,然后边振荡试管边加入2mL浓硫酸和2mL乙酸.
②小试管中装的是浓Na2CO3溶液,导气管不插入液面下是为了防止倒吸.
③相关物质的部分性质:
| 乙醇 | 乙酸 | 乙酸乙酯 | |
| 沸点 | 78.0℃ | 117.9℃ | 77.5℃ |
| 水溶性 | 易溶 | 易溶 | 难溶 |
④分离小试管中的乙酸乙酯应使用的仪器名称是分液漏斗;分离时,乙酸乙酯应该从仪器上口倒出(填“下口放”或“上口倒出”).
⑤兴趣小组多次试验后,测出乙醇与乙酸用量和最后得到的乙酸乙酯生成量如表:
| 实验序号 | 乙醇(mL) | 乙酸(mL) | 乙酸乙酯(mL) |
| a | 2 | 2 | 1.33 |
| b | 3 | 2 | 1.57 |
| c | 4 | 2 | X |
| d | 5 | 2 | 1.76 |
| e | 2 | 3 | 1.55 |
6.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1L 1mol/L的盐酸中含HCl分子的数目为NA | |
| B. | 1 mol Cl2与足量的铁反应转移的电子数是3 NA | |
| C. | 常温常压下,15g乙烷分子中含有的共价键键数目为3.5NA | |
| D. | 标准状况下,4.48 L重水(D2O)中含有的中子数为2NA |
12.在2L的密闭容器中发生反应xA(g)+yB(g)?zC(g).图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( )


| A. | 200℃时,该反应的平衡常数为25 | |
| B. | 200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol•L-1•min-1 | |
| C. | 200℃时,原平衡中再加入0.4molC,则B的物质的量分数大于25% | |
| D. | 由图乙可知,反应xA(g)+yB(g)?zC(g)的△H<0,且△S<0 |