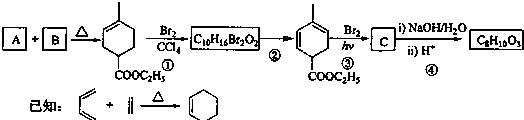
题目内容
 前四周期的五种元素A、B、C、D、E原子序数逐渐变大,其中C、D元素同主族且原子序数D为C的二倍,B的第一电离能大于C,E原子的外围电子排布为(n-l)d (n+6)ns1.由它们组成的配位化合物X为深蓝色的结晶水合物,其原子个数比为14:4:5:1:1.回答下列问题.
前四周期的五种元素A、B、C、D、E原子序数逐渐变大,其中C、D元素同主族且原子序数D为C的二倍,B的第一电离能大于C,E原子的外围电子排布为(n-l)d (n+6)ns1.由它们组成的配位化合物X为深蓝色的结晶水合物,其原子个数比为14:4:5:1:1.回答下列问题.(1)该配位化合物X的化学式为
(2)碳铂是一种含BA3分子的具有抗癌活性的金属配合物,碳铂的结构如图1,其中碳原子的杂化方式有
(3)D元素原子的最外层电子轨道表式为
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为
(5)元素B的单质可以和电石(CaC2)反应,生成氰氨化钙(CaCN2),氰氨化钙和水反应可生成NH3.与CN22-互为等电子体的分子有
(6)A元素与E元素可形成一种红色离子化合物Y,其原子个数比为1:1,该化合物Y可与稀硝酸反应,生成一种蓝色溶液和两种无色气体(其中一种为A元素的单质),写出该反应的化学方程式
考点:晶胞的计算,位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:前四周期的五种元素A、B、C、D、E原子序数逐渐变大,其中C、D元素同主族且原子序数D为C的二倍,符合条件的只有O和S元素,则C是O元素、D是S元素;
B的第一电离能大于C,而原子序数小于C,则B是N元素;
E元素的外围电子排布为(n-l)dn+6nsl,则n+6=10,故n=4,故其外围电子排布为3d104sl,则E为Cu;故该深蓝色晶体应含有[Cu(NH3)4]2+、SO42-,结合原子序数可知A为H,由原子数目之比,可知该配合物含有1个结晶水,故其化学式为:[Cu(NH3)4]SO4?H2O,
(1)通过以上分析知,X为[Cu(NH3)4]SO4?H2O;
(2)碳铂分子中C原子的价层电子对个数有的是3有的是4,根据价层电子对个数确定原子杂化方式;
(3)D是S元素,S元素原子的最外层电子为3s、3p电子,3s轨道有2个电子、3p轨道有4个电子;
(4)氢键的存在导致物质溶解性增大;
(5)价层电子数相等、原子个数相等的微粒互为得电子体;以碳化钙和水的反应书写CaCN2和水反应方程式;
(6)H元素与Cu元素可形成一种红色离子化合物Y,其原子个数比为1:1,该化合物为CuH,该化合物Y可与稀硝酸反应,生成一种蓝色溶液和两种无色气体(其中一种为A元素的单质),即生成硝酸铜、氢气、NO和水;
该晶胞的体积为a3cm3,根据ρ=
其密度.
B的第一电离能大于C,而原子序数小于C,则B是N元素;
E元素的外围电子排布为(n-l)dn+6nsl,则n+6=10,故n=4,故其外围电子排布为3d104sl,则E为Cu;故该深蓝色晶体应含有[Cu(NH3)4]2+、SO42-,结合原子序数可知A为H,由原子数目之比,可知该配合物含有1个结晶水,故其化学式为:[Cu(NH3)4]SO4?H2O,
(1)通过以上分析知,X为[Cu(NH3)4]SO4?H2O;
(2)碳铂分子中C原子的价层电子对个数有的是3有的是4,根据价层电子对个数确定原子杂化方式;
(3)D是S元素,S元素原子的最外层电子为3s、3p电子,3s轨道有2个电子、3p轨道有4个电子;
(4)氢键的存在导致物质溶解性增大;
(5)价层电子数相等、原子个数相等的微粒互为得电子体;以碳化钙和水的反应书写CaCN2和水反应方程式;
(6)H元素与Cu元素可形成一种红色离子化合物Y,其原子个数比为1:1,该化合物为CuH,该化合物Y可与稀硝酸反应,生成一种蓝色溶液和两种无色气体(其中一种为A元素的单质),即生成硝酸铜、氢气、NO和水;
该晶胞的体积为a3cm3,根据ρ=
| m |
| V |
解答:
解:前四周期的五种元素A、B、C、D、E原子序数逐渐变大,其中C、D元素同主族且原子序数D为C的二倍,符合条件的只有O和S元素,则C是O元素、D是S元素;
B的第一电离能大于C,而原子序数小于C,则B是N元素;
E元素的外围电子排布为(n-l)dn+6nsl,则n+6=10,故n=4,故其外围电子排布为3d104sl,则E为Cu;故该深蓝色晶体应含有[Cu(NH3)4]2+、SO42-,结合原子序数可知A为H,由原子数目之比,可知该配合物含有1个结晶水,故其化学式为:[Cu(NH3)4]SO4?H2O,
(1)通过以上分析知,X为[Cu(NH3)4]SO4?H2O,
故答案为:[Cu(NH3)4]SO4?H2O;
(2)碳铂分子中C原子的价层电子对个数有的是3有的是4,所以该分子中C原子杂化方式为sp2杂化和sp2杂化,故答案为:sp2杂化和sp2杂化;
(3)D是S元素,S元素原子的最外层电子为3s、3p电子,3s轨道有2个电子、3p轨道有4个电子,其最外层电子排布图为 ,故答案为:
,故答案为: ;
;
(4)氢键的存在导致物质溶解性增大,H和O元素组成的水和双氧水之间能形成氢键,所以二者能以任意比互溶,故答案为:H2O与H2O2之间形成氢键;
(5)价层电子数相等、原子个数相等的微粒互为得电子体,则与CN22-互为等电子体的分子有CO2或N2O;碳化钙和水反应生成乙炔和氢氧化钙,则CaCN2和水反应方程式为CaCN2+3H2O=CaCO3+2NH3↑,故答案为:CO2或N2O; CaCN2+3H2O=CaCO3+2NH3↑;
(6)H元素与Cu元素可形成一种红色离子化合物Y,其原子个数比为1:1,该化合物为CuH,该化合物Y可与稀硝酸反应,生成一种蓝色溶液和两种无色气体(其中一种为A元素的单质),即生成硝酸铜、氢气、NO和水,反应方程式为6CuH+16HNO3=6Cu(NO3)2+3H2↑+4NO↑+8H2O;
该晶胞的体积为a3cm3,根据ρ=
=
g/cm3=
g/cm3,故答案为:6CuH+16HNO3=6Cu(NO3)2+3H2↑+4NO↑+8H2O;
.
B的第一电离能大于C,而原子序数小于C,则B是N元素;
E元素的外围电子排布为(n-l)dn+6nsl,则n+6=10,故n=4,故其外围电子排布为3d104sl,则E为Cu;故该深蓝色晶体应含有[Cu(NH3)4]2+、SO42-,结合原子序数可知A为H,由原子数目之比,可知该配合物含有1个结晶水,故其化学式为:[Cu(NH3)4]SO4?H2O,
(1)通过以上分析知,X为[Cu(NH3)4]SO4?H2O,
故答案为:[Cu(NH3)4]SO4?H2O;
(2)碳铂分子中C原子的价层电子对个数有的是3有的是4,所以该分子中C原子杂化方式为sp2杂化和sp2杂化,故答案为:sp2杂化和sp2杂化;
(3)D是S元素,S元素原子的最外层电子为3s、3p电子,3s轨道有2个电子、3p轨道有4个电子,其最外层电子排布图为
 ,故答案为:
,故答案为: ;
;(4)氢键的存在导致物质溶解性增大,H和O元素组成的水和双氧水之间能形成氢键,所以二者能以任意比互溶,故答案为:H2O与H2O2之间形成氢键;
(5)价层电子数相等、原子个数相等的微粒互为得电子体,则与CN22-互为等电子体的分子有CO2或N2O;碳化钙和水反应生成乙炔和氢氧化钙,则CaCN2和水反应方程式为CaCN2+3H2O=CaCO3+2NH3↑,故答案为:CO2或N2O; CaCN2+3H2O=CaCO3+2NH3↑;
(6)H元素与Cu元素可形成一种红色离子化合物Y,其原子个数比为1:1,该化合物为CuH,该化合物Y可与稀硝酸反应,生成一种蓝色溶液和两种无色气体(其中一种为A元素的单质),即生成硝酸铜、氢气、NO和水,反应方程式为6CuH+16HNO3=6Cu(NO3)2+3H2↑+4NO↑+8H2O;
该晶胞的体积为a3cm3,根据ρ=
| m |
| V |
| ||
| a3 |
| 4M |
| NA×a3 |
| 4M |
| NA×a3 |
点评:本题考查晶胞计算、等电子体、氢键、电子排布、配合物等知识点,综合性较强,正确推断元素是解本题关键,这些都是高考高频点,熟练掌握物质结构知识,难点是晶胞计算,题目难度中等.

练习册系列答案
相关题目
如图甲池和乙池中的四个电极都是铂电极,乙池为K1溶液.请根据图示判断下列有关说法正确的是( )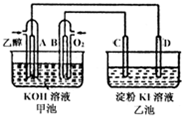

| A、甲池是电解池,乙池是原电池 |
| B、原电池的正极反应式为:C2H5OH+16OH-+12e-=2CO32-+11H2O |
| C、反应一段时间后,两池溶液的pH均未变化 |
| D、反应一段时间后,C极附近溶液变蓝 |
下列离子方程式正确的是( )
| A、向100mL 0.1mol/L的FeSO4溶液中,加入0.01mol Na2O2固体2Fe2++2Na2O2+2H2O═4Na++2Fe(OH)2+O2↑ |
| B、向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
| C、在硫酸工业中,对尾气中的SO2用过量的氨水吸收的反应:NH3?H2O+SO2=NH4++HSO3- |
| D、向20mL 0.5mol/L FeBr2溶液中通入448mL Cl2(标准状况)2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2. |
吸进人体内的氧有2%转化为氧化性极强的活性氧,这些活性氧能加速人体衰老,被称为“生命杀手”.中国科学家尝试用Na2SeO3清除人体内的活性氧,Na2SeO3的作用是( )
| A、还原剂 |
| B、氧化剂 |
| C、既是氧化剂又是还原剂 |
| D、既不是氧化剂又不是还原剂 |