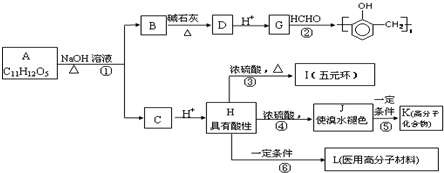
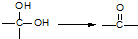题目内容
A、B、C、D、E是元素周期表前四周期中的五种常见元素,其相关信息如下表:
(1)B位于元素周期表第 周期第 族,E元素的基态原子核外电子排布式 .
(2)B、C、D三种元素的离子半径的大小关系是 (用离符号表示).A的第一电离能比B .(填“高”或“低”)
(3)A、D的简单氢化物相互反应生成的物质中化学键类型为 ,该化合物属于 晶体.
(4)金属C与E的一种红棕色氧化物在高温下可以反应,此反应常用于焊接钢轨,请写出该的反应方程式 .
| 元素 | 相关信息 |
| A | 原子核外有7种运动状态不同的电子 |
| B | 其一种单质被称为地球生物的“保护伞” |
| C | 常见的金属,在周期表中周期序数与族序数相等 |
| D | 气态氢化物及最高价氧化物对应的水化物均为强酸 |
| E | 一种核素的质量数为56,中子数为30 |
(2)B、C、D三种元素的离子半径的大小关系是
(3)A、D的简单氢化物相互反应生成的物质中化学键类型为
(4)金属C与E的一种红棕色氧化物在高温下可以反应,此反应常用于焊接钢轨,请写出该的反应方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A原子核外有7种运动状态不同的电子,则A为N元素;
B元素的一种单质被称为地球生物的“保护伞”,故B为O元素;
C为常见的金属,在周期表中周期序数与族序数相等,则C为Al元素;
D气态氢化物及最高价氧化物对应的水化物均为强酸,则D为Cl元素;
E的一种核素的质量数为56,中子数为30,则其原子序数为:56-30=26,则E为Fe元素,据此进行解答.
B元素的一种单质被称为地球生物的“保护伞”,故B为O元素;
C为常见的金属,在周期表中周期序数与族序数相等,则C为Al元素;
D气态氢化物及最高价氧化物对应的水化物均为强酸,则D为Cl元素;
E的一种核素的质量数为56,中子数为30,则其原子序数为:56-30=26,则E为Fe元素,据此进行解答.
解答:
解:A原子核外有7种运动状态不同的电子,则A为N元素;B元素的一种单质被称为地球生物的“保护伞”,故B为O元素;C为常见的金属,在周期表中周期序数与族序数相等,则C为Al元素;D气态氢化物及最高价氧化物对应的水化物均为强酸,则D为Cl元素;E的一种核素的质量数为56,中子数为30,则其原子序数为:56-30=26,则E为Fe元素,
(1)B为O元素,氧元素的核电荷数为8,核外电子层数为2,最外层为6个电子,位于周期表在第二周期ⅥA族;
Fe是26元素,核外电子数为26,态原子的核外电子排布式为:1s22s22p63s23p63d64s2,
故答案为:二;ⅥA;1s22s22p63s23p63d64s2;
(2)B为O、C为Al、D为Cl元素,电子层数越大半径越大,电子层数相同时,核电荷数越大,半径越小,可以判断B、C、D三种元素的简单离子半径的大小关系为:C1->O2->Al3+;
A为N元素,由于N原子的2p轨道处于半满状态,比较稳定,则第一电离能N>O,即:A的第一电离能比B高,
故答案为:C1->O2->Al3+;高;
(3)A为N元素、D为Cl元素,A、D的简单氢化物分别为氨气和氯化氢,二者相互反应生成的物质为氯化铵,氯化铵中含有离子键和共价键,氯化铵晶体属于离子晶体,
故答案为:离子键、共价键;离子;
(4)C为Al、E为Fe元素,金属C与E的一种红棕色氧化物氧化铁在高温下可以发生铝热反应,该的反应化学方程式为:2Al+Fe2O3
AL2O3+2Fe,
故答案为:2Al+Fe2O3
AL2O3+2Fe.
(1)B为O元素,氧元素的核电荷数为8,核外电子层数为2,最外层为6个电子,位于周期表在第二周期ⅥA族;
Fe是26元素,核外电子数为26,态原子的核外电子排布式为:1s22s22p63s23p63d64s2,
故答案为:二;ⅥA;1s22s22p63s23p63d64s2;
(2)B为O、C为Al、D为Cl元素,电子层数越大半径越大,电子层数相同时,核电荷数越大,半径越小,可以判断B、C、D三种元素的简单离子半径的大小关系为:C1->O2->Al3+;
A为N元素,由于N原子的2p轨道处于半满状态,比较稳定,则第一电离能N>O,即:A的第一电离能比B高,
故答案为:C1->O2->Al3+;高;
(3)A为N元素、D为Cl元素,A、D的简单氢化物分别为氨气和氯化氢,二者相互反应生成的物质为氯化铵,氯化铵中含有离子键和共价键,氯化铵晶体属于离子晶体,
故答案为:离子键、共价键;离子;
(4)C为Al、E为Fe元素,金属C与E的一种红棕色氧化物氧化铁在高温下可以发生铝热反应,该的反应化学方程式为:2Al+Fe2O3
| ||
故答案为:2Al+Fe2O3
| ||
点评:本题考查了物质、结构与性质关系的综合应用,题目难度中等,根据题干信息及所学知识正确推断各元素名称为解答关键,注意掌握元素周期表结构、元素周期律内容.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列叙述正确的是( )
| A、1molH2燃烧放出的热量为H2的燃烧热 |
| B、pH=4的醋酸溶液中,c(CH3COOH)=0.1mol?L-1 |
| C、在NaS溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-) |
| D、NaCl和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
在下列物质分类中,前者包括后者的是( )
| A、氧化物 化合物 |
| B、溶液 分散系 |
| C、溶液 胶体 |
| D、化合物 电解质 |
现有甲、乙、丙、丁四种常温下呈气态的有机物,它们都由两种相同的短周期元素组成,它们的分子中所含电子数如表所示:
下列关于甲、乙、丙、丁的推断正确的是( )
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 电子数 | 10 | 14 | 16 | 18 |
| A、四种气体中至少有两种气体互为同分异构体 |
| B、四种气体通入Br2的CCl4溶液中,都能使其褪色 |
| C、气体丙分子中的所有原子在同一平面 |
| D、鉴别乙和丙两种气体,可以用酸性高锰酸钾溶液 |
化学与生产、生活密切相关.下列说法正确的是( )
| A、硅胶吸附能力强,常用作催化剂载体和食品干燥剂 |
| B、福尔马林可用于保存海鲜产品 |
| C、天然纤维和合成纤维的主要成分都是纤维素 |
| D、工业上利用Cl2与澄清石灰水反应制取漂白粉 |
 前四周期的五种元素A、B、C、D、E原子序数逐渐变大,其中C、D元素同主族且原子序数D为C的二倍,B的第一电离能大于C,E原子的外围电子排布为(n-l)d (n+6)ns1.由它们组成的配位化合物X为深蓝色的结晶水合物,其原子个数比为14:4:5:1:1.回答下列问题.
前四周期的五种元素A、B、C、D、E原子序数逐渐变大,其中C、D元素同主族且原子序数D为C的二倍,B的第一电离能大于C,E原子的外围电子排布为(n-l)d (n+6)ns1.由它们组成的配位化合物X为深蓝色的结晶水合物,其原子个数比为14:4:5:1:1.回答下列问题. ; ②
; ②