题目内容
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.请回答下列问题:
(1)Y在元素周期表中的位置为 .
(2)上述元素的最高价氧化物对应的水化物酸性最强的是 (填名称),非金属气态氢化物还原性最强的是 (填化学式).
(3)ZX与水反应放出气体的化学方程式为 ,用电子式表示ZX的形成过程 .
(4)X2M的燃烧热△H=-a kJ/mol.写出X2M燃烧反应的热化学方程式 .
(5)已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ/mol;2NO(g)+O2(g)═2NO2(g)△H=-113.0kJ/mol,则反应NO2(g)+SO2(g)?SO3(g)+NO(g)△H= kJ/mol.
(1)Y在元素周期表中的位置为
(2)上述元素的最高价氧化物对应的水化物酸性最强的是
(3)ZX与水反应放出气体的化学方程式为
(4)X2M的燃烧热△H=-a kJ/mol.写出X2M燃烧反应的热化学方程式
(5)已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ/mol;2NO(g)+O2(g)═2NO2(g)△H=-113.0kJ/mol,则反应NO2(g)+SO2(g)?SO3(g)+NO(g)△H=
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大,所以X是H元素;X、Z同主族,可形成离子化合物ZX,且Y原子序数大于Y原子序数,所以Z是Na元素;Y、M同主族,可形成MY2、MY3两种分子,所以Y是O元素,M是S元素,G是短周期主族元素,所以G是Cl元素(不考虑稀有气体),据此解答,
解答:
解:X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大,所以X是H元素;X、Z同主族,可形成离子化合物ZX,且Y原子序数大于Y原子序数,所以Z是Na元素;Y、M同主族,可形成MY2、MY3两种分子,所以Y是O元素,M是S元素,G是短周期主族元素,所以G是Cl元素(不考虑稀有气体),
(1)Y是O元素,O原子有2个电子层,最外层电子数为6,处于第二周期第ⅥA族,故答案为:第二周期第ⅥA族;
(2)非金属元素的非金属性越强,其相应的最高价含氧酸的酸性越强,这几种元素非金属性最强的是Cl元素,所以其最高价含氧酸的酸性最强的是高氯酸HClO4,
非金属性越弱,气态氢化物还原性越强,还原性最强的气态氢化物是H2S,
故答案为:HClO4;H2S;
(3)ZX为NaH,NaH与水反应是氢氧化钠与氢气,反应化学方程式为为:NaH+H2O=NaOH+H2↑,用电子式表示NaH的形成过程为 ,
,
故答案为:NaH+H2O=NaOH+H2↑; ;
;
(4)H2S的燃烧热△H=-a kJ?mol-1,根据燃烧热的含义,H2S燃烧的热化学方程式生成物应该生成SO2,故H2S燃烧反应的热化学方程式为:2H2S(g)+3O2(g)=2 SO2(g)+2H2O(l)△H=-2aKJ?mol-1,
故答案为:2H2S(g)+3O2(g)=2 SO2(g)+2H2O(l)△H=-2aKJ?mol-1;
(5)已知:①2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ/mol;②2NO(g)+O2(g)═2NO2(g)△H=-113.0kJ/mol,根据盖斯定律,将反应
可得反应NO2(g)+SO2(g)?SO3(g)+NO(g),则反应热△H=
=-41.8kJ/mol,故答案为:-41.8.
(1)Y是O元素,O原子有2个电子层,最外层电子数为6,处于第二周期第ⅥA族,故答案为:第二周期第ⅥA族;
(2)非金属元素的非金属性越强,其相应的最高价含氧酸的酸性越强,这几种元素非金属性最强的是Cl元素,所以其最高价含氧酸的酸性最强的是高氯酸HClO4,
非金属性越弱,气态氢化物还原性越强,还原性最强的气态氢化物是H2S,
故答案为:HClO4;H2S;
(3)ZX为NaH,NaH与水反应是氢氧化钠与氢气,反应化学方程式为为:NaH+H2O=NaOH+H2↑,用电子式表示NaH的形成过程为
 ,
,故答案为:NaH+H2O=NaOH+H2↑;
 ;
;(4)H2S的燃烧热△H=-a kJ?mol-1,根据燃烧热的含义,H2S燃烧的热化学方程式生成物应该生成SO2,故H2S燃烧反应的热化学方程式为:2H2S(g)+3O2(g)=2 SO2(g)+2H2O(l)△H=-2aKJ?mol-1,
故答案为:2H2S(g)+3O2(g)=2 SO2(g)+2H2O(l)△H=-2aKJ?mol-1;
(5)已知:①2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ/mol;②2NO(g)+O2(g)═2NO2(g)△H=-113.0kJ/mol,根据盖斯定律,将反应
| ①-② |
| 2 |
| -196.6kJ/mol-(-113.0kJ/mol) |
| 2 |
点评:本题主要考查了电子式、元素周期律、热化学方程式、盖斯定律等知识,中等难度,解题的关键是元素推断,答题时注意审题.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目
NA为阿佛伽德罗常数,下列说法正确的是( )
| A、1L1.0mol?L-1的NaAlO2的水溶液中含氧原子个数为2NA |
| B、12g石墨烯(单层石墨)中含有六元环个数为0.5NA |
| C、25℃时pH=13的NaOH溶液中含有的0H-数目为0.1NA |
| D、0.1mol基和0.1mol氢氧根离子所含电子数均为0.9NA |
下列对化学反应的认识正确的是( )
| A、化学反应过程中,分子的种类和数目一定发生改变 |
| B、如果某化学反应的△H和△S均小于0,则反应一定能自发进行 |
| C、化学反应过程中,一定有化学键的断裂和形成 |
| D、放热反应的反应速率,一定比吸热反应的反应速率快 |
 前四周期的五种元素A、B、C、D、E原子序数逐渐变大,其中C、D元素同主族且原子序数D为C的二倍,B的第一电离能大于C,E原子的外围电子排布为(n-l)d (n+6)ns1.由它们组成的配位化合物X为深蓝色的结晶水合物,其原子个数比为14:4:5:1:1.回答下列问题.
前四周期的五种元素A、B、C、D、E原子序数逐渐变大,其中C、D元素同主族且原子序数D为C的二倍,B的第一电离能大于C,E原子的外围电子排布为(n-l)d (n+6)ns1.由它们组成的配位化合物X为深蓝色的结晶水合物,其原子个数比为14:4:5:1:1.回答下列问题.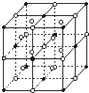 A、B、C、D是短周期元素,它们的离子具有相同的电子层结构,且半径依次减小.A与D的化合物X既能与盐酸反应,又能与NaOH溶液反应;B、C组成典型的离子化合物Y,其晶体结构类似于NaCl晶体;A与C以原子个数之比1:1组成化合物Z.
A、B、C、D是短周期元素,它们的离子具有相同的电子层结构,且半径依次减小.A与D的化合物X既能与盐酸反应,又能与NaOH溶液反应;B、C组成典型的离子化合物Y,其晶体结构类似于NaCl晶体;A与C以原子个数之比1:1组成化合物Z.