题目内容
已知在常用催化剂(如铂、钯)的催化下,氢气和炔烃加成生成烷烃,难于得到烯烃,但使用活性较低的林德拉催化剂,可使炔烃的氢化停留在生成烯烃的阶段,而不再进一步氢化.现有一课外活动兴趣小组利用上述设计了一套由如下图所示仪器组装而成的实验装置(铁架台未画出),拟由乙炔制得乙烯,并测定乙炔氢化的转化率.若用含0.020molCaC2的电石和1.60g含杂质18.7%的锌粒(杂质不与酸反应)分别与足量的X和稀硫酸反应,当反应完全后,假定在标准状况下测得G中收集到的水VmL.试回答有关问题.
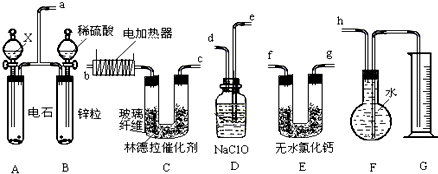
(1)所用装置的连接顺序是 (填各接口的字母).
(2)写出A、C中所发生的两个反应的化学方程式(有机物写结构简式):A 、C .
(3)D的作用是 ,若将装置撤去对G装置的影响是 .
(4)为减慢A中的反应速率,X应选用 .
(5)F中留下的气体除含少许空气外,还有 .
(6)若V=672mL(导管内气体体积忽略不计),则乙炔氢化的转化率为 .

(1)所用装置的连接顺序是
(2)写出A、C中所发生的两个反应的化学方程式(有机物写结构简式):A
(3)D的作用是
(4)为减慢A中的反应速率,X应选用
(5)F中留下的气体除含少许空气外,还有
(6)若V=672mL(导管内气体体积忽略不计),则乙炔氢化的转化率为
考点:性质实验方案的设计
专题:实验设计题
分析:(1)根据实验的目的是用乙炔和氢气之间的反应来制取乙烯,根据装置的特点和应用来连接实验装置;
(2)碳化钙可以和水反应得到乙炔气体,乙炔气体和氢气在催化剂的作用下反应得到乙烯;
(3)乙炔在制取的过程中,还会含有杂质气体,要进行除杂,并进行干燥,根据实验目的和信息书写化学方程式;
(4)为减慢反应速率,可以将水换成饱和食盐水;
(5)根据发生的反应结合实验实际情况来确定存在的杂质气体;
(6)根据反应:CaC2+2H2O→HC≡CH↑+Ca(OH)2、HC≡CH+H2
CH2=CH2结合乙炔氢化的转化率等于反应的乙炔和全部的乙炔的量的比值来计算.
(2)碳化钙可以和水反应得到乙炔气体,乙炔气体和氢气在催化剂的作用下反应得到乙烯;
(3)乙炔在制取的过程中,还会含有杂质气体,要进行除杂,并进行干燥,根据实验目的和信息书写化学方程式;
(4)为减慢反应速率,可以将水换成饱和食盐水;
(5)根据发生的反应结合实验实际情况来确定存在的杂质气体;
(6)根据反应:CaC2+2H2O→HC≡CH↑+Ca(OH)2、HC≡CH+H2
| 林德拉催化剂 |
解答:
解:(1)实验装置显示制取乙炔和氢气,然后将二者混合,但是乙炔、氢气中含有杂质气体,应该先将杂质气体除去,再将之干燥,是纯净的气体在催化剂的作用下发生反应得到乙烯,乙烯是难溶于水的气体,可以采用排水法收集,所以装置的连接顺序是:a、e、d、f、g、b、c、h(f、g可调换),故答案为:a、e、d、f、g、b、c、h(f、g可调换);
(2)A中是碳化钙和水反应制取乙炔的过程,C中是乙炔和氢气之间的加成反应,方程式分别为:CaC2+2H2O→HC≡CH↑+Ca(OH)2、HC≡CH+H2
CH2=CH2,故答案为:CaC2+2H2O→HC≡CH↑+Ca(OH)2、HC≡CH+H2
CH2=CH2;
(3)为了保证得到的气体纯净,应该将气体进行除杂,次氯酸钠具有碱性和氧化性,可以除去杂质,如果没有除去杂质,则剩余的气体增加,测得的结果比实际值偏高,故答案为:除去杂质气体;导致实验结果偏高;
(4)碳化钙和水之间的反应十分剧烈,为减慢反应速率,可以将水换成饱和食盐水,故答案为:饱和食盐水;
(5)F中留下的气体除含少许空气外,还有没有完全消耗的乙炔,氢气以及生成的乙烯等气体,故答案为:H2、C2H4、C2H2;
(6)0.020molCaC2的电石,和水反应得到乙炔的物质的量是0.02mol,1.60g含杂质18.7%的锌粒(杂质不与酸反应)的物质的量是:
mol=0.02mol,和硫酸反应,产生的氢气的物质的量是0.005mol,状况下测得G中收集到的水VmL,V=672mL,则得到的乙烯的物质的量是
=0.03mol,
设乙炔的转化量是x,则HC≡CH+H2
CH2=CH2
1 1 1
x x x
则反应后得到气体的物质的量(0.02-x)+(0.02-x)+x=0.03,解得X=0.01mol,所以乙炔氢化的转化率为
×100%
=50%,故答案为:50%.
(2)A中是碳化钙和水反应制取乙炔的过程,C中是乙炔和氢气之间的加成反应,方程式分别为:CaC2+2H2O→HC≡CH↑+Ca(OH)2、HC≡CH+H2
| 林德拉催化剂 |
| 林德拉催化剂 |
(3)为了保证得到的气体纯净,应该将气体进行除杂,次氯酸钠具有碱性和氧化性,可以除去杂质,如果没有除去杂质,则剩余的气体增加,测得的结果比实际值偏高,故答案为:除去杂质气体;导致实验结果偏高;
(4)碳化钙和水之间的反应十分剧烈,为减慢反应速率,可以将水换成饱和食盐水,故答案为:饱和食盐水;
(5)F中留下的气体除含少许空气外,还有没有完全消耗的乙炔,氢气以及生成的乙烯等气体,故答案为:H2、C2H4、C2H2;
(6)0.020molCaC2的电石,和水反应得到乙炔的物质的量是0.02mol,1.60g含杂质18.7%的锌粒(杂质不与酸反应)的物质的量是:
| 1.6(1-18.7%) |
| 65 |
| 0.672L |
| 22.4L/mol |
设乙炔的转化量是x,则HC≡CH+H2
| 林德拉催化剂 |
1 1 1
x x x
则反应后得到气体的物质的量(0.02-x)+(0.02-x)+x=0.03,解得X=0.01mol,所以乙炔氢化的转化率为
| 0.01mol |
| 0.02mol |
=50%,故答案为:50%.
点评:本题是一道考查学生物质的制备实验方案的设计题,考查学生分析和解决问题的能力,难度大.

练习册系列答案
相关题目
化学与生产、生活密切相关.下列说法正确的是( )
| A、硅胶吸附能力强,常用作催化剂载体和食品干燥剂 |
| B、福尔马林可用于保存海鲜产品 |
| C、天然纤维和合成纤维的主要成分都是纤维素 |
| D、工业上利用Cl2与澄清石灰水反应制取漂白粉 |
下列可以大量共存且溶液是无色的离子组是( )
| A、H+、Na+、NO3-、Cu2+ |
| B、Ba2+、Mg2+、Cl-、SO42- |
| C、Mg2+、K+、OH-、NO3- |
| D、NO3-、SO42-、K+、Mg2+ |
下列说法正确的是( )
| A、相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3?H2O其c(NH4+)由大到小的顺序是:①>②>③>④ |
| B、某物质的溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14-a |
| C、物质的量浓度相等的H2S、NaHS混合溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-)? |
| D、AgCl悬浊液中存在平衡:AgCl(s)?Ag+(aq)+Cl- (aq),往其中加入少量NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小 |
 前四周期的五种元素A、B、C、D、E原子序数逐渐变大,其中C、D元素同主族且原子序数D为C的二倍,B的第一电离能大于C,E原子的外围电子排布为(n-l)d (n+6)ns1.由它们组成的配位化合物X为深蓝色的结晶水合物,其原子个数比为14:4:5:1:1.回答下列问题.
前四周期的五种元素A、B、C、D、E原子序数逐渐变大,其中C、D元素同主族且原子序数D为C的二倍,B的第一电离能大于C,E原子的外围电子排布为(n-l)d (n+6)ns1.由它们组成的配位化合物X为深蓝色的结晶水合物,其原子个数比为14:4:5:1:1.回答下列问题. A、B、C、D是短周期元素,它们的离子具有相同的电子层结构,且半径依次减小.A与D的化合物X既能与盐酸反应,又能与NaOH溶液反应;B、C组成典型的离子化合物Y,其晶体结构类似于NaCl晶体;A与C以原子个数之比1:1组成化合物Z.
A、B、C、D是短周期元素,它们的离子具有相同的电子层结构,且半径依次减小.A与D的化合物X既能与盐酸反应,又能与NaOH溶液反应;B、C组成典型的离子化合物Y,其晶体结构类似于NaCl晶体;A与C以原子个数之比1:1组成化合物Z.