题目内容
下列离子方程式正确的是( )
| A、向100mL 0.1mol/L的FeSO4溶液中,加入0.01mol Na2O2固体2Fe2++2Na2O2+2H2O═4Na++2Fe(OH)2+O2↑ |
| B、向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
| C、在硫酸工业中,对尾气中的SO2用过量的氨水吸收的反应:NH3?H2O+SO2=NH4++HSO3- |
| D、向20mL 0.5mol/L FeBr2溶液中通入448mL Cl2(标准状况)2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2. |
考点:离子方程式的书写
专题:离子反应专题
分析:A.二价铁离子能够被过氧化钠氧化;
B.向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全,反应生成硫酸钡、偏铝酸钠和水;
C.不符合反应的客观事实,二氧化硫少量生成亚硫酸铵;
D.20mL 0.5mol/L FeBr2溶液含有FeBr2物质的量为:0.01mol,448mL Cl2的物质的量为0.02mol,氯气先氧化二价铁离子,再氧化溴离子.
B.向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全,反应生成硫酸钡、偏铝酸钠和水;
C.不符合反应的客观事实,二氧化硫少量生成亚硫酸铵;
D.20mL 0.5mol/L FeBr2溶液含有FeBr2物质的量为:0.01mol,448mL Cl2的物质的量为0.02mol,氯气先氧化二价铁离子,再氧化溴离子.
解答:
解:A.0.01molFeSO4与0.01molNa2O2固体反应的离子方程式为:4Na2O2+6H2O+4Fe2+=8Na++O2↑+4Fe(OH)3↓,故A错误;
B.向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全,离子方程式为:H++SO42-+Ba2++OH-═BaSO4↓+H2O,故B错误;
C.在硫酸工业中,对尾气中的SO2用过量的氨水吸收的反应,离子方程式:2NH3?H2O+SO2=H2O+2NH4++SO32-,故C错误;
D.20mL 0.5mol/L FeBr2溶液含有FeBr2物质的量为:0.01mol,448mL Cl2的物质的量为0.02mol,二者恰好反应生成氯化铁和溴单质,离子方程式为:
2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2,故D正确;
故选:D.
B.向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全,离子方程式为:H++SO42-+Ba2++OH-═BaSO4↓+H2O,故B错误;
C.在硫酸工业中,对尾气中的SO2用过量的氨水吸收的反应,离子方程式:2NH3?H2O+SO2=H2O+2NH4++SO32-,故C错误;
D.20mL 0.5mol/L FeBr2溶液含有FeBr2物质的量为:0.01mol,448mL Cl2的物质的量为0.02mol,二者恰好反应生成氯化铁和溴单质,离子方程式为:
2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2,故D正确;
故选:D.
点评:本题考查了离子方程式的书写,题目难度较大,侧重考查反应物用量对反应的影响,明确反应的实质是解题关键,AD为易错选项.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
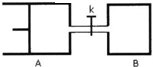 如图所示,向A和B中都充入2molX和2molY,起始VA=0.8aL,VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应x(g)+Y(g)?2Z(g)+w(g),达到平衡时,VA=0.9aL,则下列说法错误的是( )
如图所示,向A和B中都充入2molX和2molY,起始VA=0.8aL,VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应x(g)+Y(g)?2Z(g)+w(g),达到平衡时,VA=0.9aL,则下列说法错误的是( )| A、两容器中达到平衡的时间A<B |
| B、A容器中X的转化率为25%,且比B容器中X的转化率小 |
| C、打开K达新平衡后,升高B容器温度,A容器体积一定增大 |
| D、打开K一段时间达平衡时,A的体积为0.8aL(连通管中气体体积不计) |
下列物质中既含有共价键又含离子键的化合物是( )
| A、NaCl |
| B、Al2O3 |
| C、NaOH |
| D、C6H6 |
NA为阿佛伽德罗常数,下列说法正确的是( )
| A、1L1.0mol?L-1的NaAlO2的水溶液中含氧原子个数为2NA |
| B、12g石墨烯(单层石墨)中含有六元环个数为0.5NA |
| C、25℃时pH=13的NaOH溶液中含有的0H-数目为0.1NA |
| D、0.1mol基和0.1mol氢氧根离子所含电子数均为0.9NA |
已知1.505×1023个X气体分子的质量为16g,则X气体的摩尔质量是( )
| A、64g |
| B、32g |
| C、64g/mol |
| D、32g/mol |
在下列物质分类中,前者包括后者的是( )
| A、氧化物 化合物 |
| B、溶液 分散系 |
| C、溶液 胶体 |
| D、化合物 电解质 |
 前四周期的五种元素A、B、C、D、E原子序数逐渐变大,其中C、D元素同主族且原子序数D为C的二倍,B的第一电离能大于C,E原子的外围电子排布为(n-l)d (n+6)ns1.由它们组成的配位化合物X为深蓝色的结晶水合物,其原子个数比为14:4:5:1:1.回答下列问题.
前四周期的五种元素A、B、C、D、E原子序数逐渐变大,其中C、D元素同主族且原子序数D为C的二倍,B的第一电离能大于C,E原子的外围电子排布为(n-l)d (n+6)ns1.由它们组成的配位化合物X为深蓝色的结晶水合物,其原子个数比为14:4:5:1:1.回答下列问题.