题目内容
如图甲池和乙池中的四个电极都是铂电极,乙池为K1溶液.请根据图示判断下列有关说法正确的是( )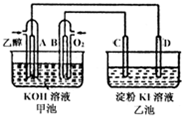

| A、甲池是电解池,乙池是原电池 |
| B、原电池的正极反应式为:C2H5OH+16OH-+12e-=2CO32-+11H2O |
| C、反应一段时间后,两池溶液的pH均未变化 |
| D、反应一段时间后,C极附近溶液变蓝 |
考点:原电池和电解池的工作原理
专题:
分析:A、甲为燃料电池,乙有外加电源时电解池;
B、C2H5OH在碱性条件下失电子生成碳酸盐;
C、甲中消耗氢氧化钾,乙池中为惰性电极电解氯化钠溶液;
D、乙池为电解池,D为阴极,氢离子得电子,C为阳极,氯离子失电子.
B、C2H5OH在碱性条件下失电子生成碳酸盐;
C、甲中消耗氢氧化钾,乙池中为惰性电极电解氯化钠溶液;
D、乙池为电解池,D为阴极,氢离子得电子,C为阳极,氯离子失电子.
解答:
解:A、甲中两极分别通入氧气和乙醇为燃料电池,乙有外加电源时电解池,故A错误;
B、C2H5OH在碱性条件下放电失去电子生成碳酸盐,方程式为:C2H5OH+16OH--12e-═2CO32-+11H2O,故B错误;
C、甲中消耗氢氧化钾,pH减小,乙池中为惰性电极电解氯化钠溶液,电解产物为氯气、氢气、氢氧化钠,所以电解后pH增大,故C错误;
D、乙池为电解池,D为阴极,氢离子得电子,C为阳极,氯离子失电子,则在C极附近生成氯气,故用湿润淀粉KI试纸靠近乙池C电极变蓝,故D正确;
故选D.
B、C2H5OH在碱性条件下放电失去电子生成碳酸盐,方程式为:C2H5OH+16OH--12e-═2CO32-+11H2O,故B错误;
C、甲中消耗氢氧化钾,pH减小,乙池中为惰性电极电解氯化钠溶液,电解产物为氯气、氢气、氢氧化钠,所以电解后pH增大,故C错误;
D、乙池为电解池,D为阴极,氢离子得电子,C为阳极,氯离子失电子,则在C极附近生成氯气,故用湿润淀粉KI试纸靠近乙池C电极变蓝,故D正确;
故选D.
点评:本题考查了原电池、电解池原理、热化学反应方程式的书写,明确燃料电池正负极的判断方法、电解池离子放电顺序即可解答,难点是电极反应式的书写,难度中等.

练习册系列答案
相关题目
有关化学化学平衡状态的特征,下列说法正确的是( )
| A、所有的化学反应都存在化学平衡状态 |
| B、平衡时反应已经达到最大限度,反应停止了 |
| C、平衡时各组分的浓度相等 |
| D、化学平衡状态是一种动态平衡 |
 如图所示,向A和B中都充入2molX和2molY,起始VA=0.8aL,VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应x(g)+Y(g)?2Z(g)+w(g),达到平衡时,VA=0.9aL,则下列说法错误的是( )
如图所示,向A和B中都充入2molX和2molY,起始VA=0.8aL,VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应x(g)+Y(g)?2Z(g)+w(g),达到平衡时,VA=0.9aL,则下列说法错误的是( )| A、两容器中达到平衡的时间A<B |
| B、A容器中X的转化率为25%,且比B容器中X的转化率小 |
| C、打开K达新平衡后,升高B容器温度,A容器体积一定增大 |
| D、打开K一段时间达平衡时,A的体积为0.8aL(连通管中气体体积不计) |
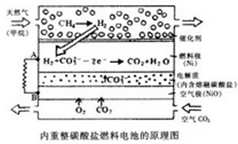 以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如图,下列说法正确的是( )
以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如图,下列说法正确的是( )| A、该电池将热能转化为电能 |
| B、外电子流动方向:由B流向A |
| C、空气极发生电极反应式为:O2+4c-+2CO2=2CO32- |
| D、以此电池为电源电解精炼铜,当有0.1mole-转移时,有3.2g铜溶解 |
下列叙述正确的是( )
| A、1molH2燃烧放出的热量为H2的燃烧热 |
| B、pH=4的醋酸溶液中,c(CH3COOH)=0.1mol?L-1 |
| C、在NaS溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-) |
| D、NaCl和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
下列物质中既含有共价键又含离子键的化合物是( )
| A、NaCl |
| B、Al2O3 |
| C、NaOH |
| D、C6H6 |
NA为阿佛伽德罗常数,下列说法正确的是( )
| A、1L1.0mol?L-1的NaAlO2的水溶液中含氧原子个数为2NA |
| B、12g石墨烯(单层石墨)中含有六元环个数为0.5NA |
| C、25℃时pH=13的NaOH溶液中含有的0H-数目为0.1NA |
| D、0.1mol基和0.1mol氢氧根离子所含电子数均为0.9NA |
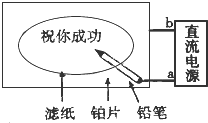 某学生设计了一个“黑笔写红字”的趣味实验,如图所示.滤纸先用氯化钠、无色酚酞的混合液浸湿,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,回答下列
某学生设计了一个“黑笔写红字”的趣味实验,如图所示.滤纸先用氯化钠、无色酚酞的混合液浸湿,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,回答下列 前四周期的五种元素A、B、C、D、E原子序数逐渐变大,其中C、D元素同主族且原子序数D为C的二倍,B的第一电离能大于C,E原子的外围电子排布为(n-l)d (n+6)ns1.由它们组成的配位化合物X为深蓝色的结晶水合物,其原子个数比为14:4:5:1:1.回答下列问题.
前四周期的五种元素A、B、C、D、E原子序数逐渐变大,其中C、D元素同主族且原子序数D为C的二倍,B的第一电离能大于C,E原子的外围电子排布为(n-l)d (n+6)ns1.由它们组成的配位化合物X为深蓝色的结晶水合物,其原子个数比为14:4:5:1:1.回答下列问题.