题目内容
17.25℃时,在某物质的溶液中,由水电离出的c(H+)=1×10-amol/L,下列说法正确的是( )| A. | a<7时,水的电离受到抑制 | B. | a>7时,水的电离受到抑制 | ||
| C. | a<7时,溶液的pH一定为a | D. | a>7时,溶液的pH一定为14-a |
分析 酸或碱抑制水电离,含有弱离子的盐促进水电离,由水电离出的c(H+)=1×10-amol/L,如果a>7,说明水电离程度减小,水的电离受抑制,溶质可能是酸或碱;如果a<7,说明水电离程度增大,促进水电离,溶质可能是含有弱离子的盐.
解答 解:酸或碱抑制水电离,含有弱离子的盐促进水电离,由水电离出的c(H+)=1×10-amol/L,如果a>7,说明水电离程度减小,水的电离受抑制,溶质可能是酸或碱;如果a<7,说明水电离程度增大,促进水电离,溶质可能是含有弱离子的盐,该溶液的pH可能为a或14-a,
故选B.
点评 本题以溶液的pH计算为载体考查水的电离,为高频考点,明确酸碱盐对水电离影响原理是解本题关键,难点是判断溶液pH的计算,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案
相关题目
5.已知aA+、bB2+、cC-、dD2-四种离子均具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是( )
| A. | 原子半径:A>B>C>D | B. | 原子序数:b>a>c>d | ||
| C. | 离子半径:D>C>B>A | D. | a+1=d-2 |
12.下列电离方程式正确的是( )
| A. | NH4Cl=NH4++Cl- | B. | NaHSO4=Na++HSO42- | ||
| C. | H2CO3=2H++CO32- | D. | CH3COOH→CH3++COOH- |
9.向铁和氧化铁的混合物中加入足量的稀H2SO4,充分反应后生成FeSO4溶液,当生成的Fe2+和H2的物质的量之比为4:1时,被氧化的铁与被还原的铁的物质的量之比是( )
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 1:3 |
7.下列化学用语正确的是( )
| A. | H2S的电子式:H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{S}}{••}$${\;}_{•}^{•}$]2-H+ | |
| B. | Mg2+的结构示意图: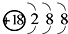 | |
| C. | Na2O的电子式:Na${\;}_{2}^{+}$[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$]2- | |
| D. | N2的电子式: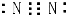 |
 ,离子键,共价键;
,离子键,共价键;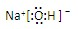 ,离子键,共价键;
,离子键,共价键; ;共价键;
;共价键; ,共价键,离子键.
,共价键,离子键.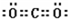 ;共价键;
;共价键; ;共价键.
;共价键.