题目内容
17.化合物F是一种常见的化工原料,可以通过以下方法合成: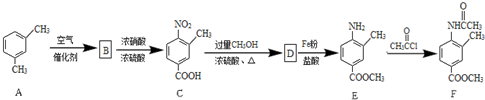
(1)写出化合物D中官能团的名称:酯基和硝基.
(2)由E→F的反应类型是取代反应.
(3)写出B→C反应的化学方程式:
 .
.(4)写出同时满足下列条件的E的一种同分异构体的结构简式:
 .
.Ⅰ.能发生银镜反应;Ⅱ.水解产物之一遇FeCl3溶液显色;Ⅲ.分子中含有4种不同化学环境的氢.
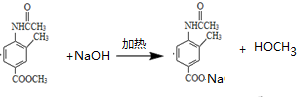
(5)请写出F与足量氢氧化钠溶液反应的化学方程式
 .
.
分析 根据题中各物质转化关系,比较A和C的结构可知,间二甲苯在催化剂的条件下被空气氧化得B为 ,B发生硝化反应生成C,C发生酯化反应生成D为
,B发生硝化反应生成C,C发生酯化反应生成D为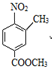 ,D被铁粉还原得E,E发生取代反应生成F,据此答题.
,D被铁粉还原得E,E发生取代反应生成F,据此答题.
解答 解:根据题中各物质转化关系,比较A和C的结构可知,间二甲苯在催化剂的条件下被空气氧化得B为 ,B发生硝化反应生成C,C发生酯化反应生成D为
,B发生硝化反应生成C,C发生酯化反应生成D为 ,D被铁粉还原得E,E发生取代反应生成F,
,D被铁粉还原得E,E发生取代反应生成F,
(1)D为 ,所含有官能团为酯基和硝基,故答案为:酯基和硝基;
,所含有官能团为酯基和硝基,故答案为:酯基和硝基;
(2)根据上面分析可知E发生取代反应生成F,
故答案为:取代反应;
(3)B发生取代反应生成C,反应方程式为 ,
,
故答案为: ;
;
(4)根据条件Ⅰ.能发生银镜反应,说明有醛基;Ⅱ.水解产物之一遇FeCl3溶液显色,水解产物有酚羟基;Ⅲ.分子中含有4种不同化学环境的氢,结合E的结构书可知,其同分异构体为 ,
,
故答案为: ;
;
(5)F与足量氢氧化钠溶液发生水解反应,反应的化学方程式为 ,
,
故答案为: .
.
点评 本题考查有机物推断,侧重考查分析、推断能力,涉及常见官能团之间的转化,根据已知物质结构结合反应条件采用正逆结合的方法进行推断,熟练掌握常见有机物的结构和性质,题目难度不大,注意应用题中信息.

练习册系列答案
相关题目
8.页岩气是蕴藏于页岩层中的天然气,我州页岩气蕴藏量达4.81万亿立方米,约占全省近7成,可采储量超过1.443万亿立方米.页岩气将是我州能源开发的重要方向.下列有关结论中错误的是( )
| A. | 页岩气是一种清洁的能源 | |
| B. | 使用页岩气是对化学能的充分利用 | |
| C. | 使用页岩气给农民的生活带来了不便 | |
| D. | 页岩气是我州解决能源的重要途径 |
5.在NaBr和NaI的混合物溶液中通入过量的Cl2把溶液蒸干后并将剩余物灼烧,最后剩余物质是( )
| A. | NaCl、Br2、I2 | B. | NaCl | C. | NaCl、Br2 | D. | NaCl、I2 |
12.同温同压下,将一定量的硫化氢和二氧化硫混合后恰好完全反应,若反应中转移的电子是1mol,则在反应中生成的硫为( )
| A. | 1 mol | B. | 0.75 mol | C. | 0.5 mol | D. | 0.25 mol |
2.下列表示物质结构的化学用语或模型正确的是( )
| A. | C原子外围电子排布图: | B. | 硫原子结构示意图: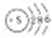 | ||
| C. | 二氧化硅的分子式:SiO2 | D. | 苯的比例模型: |
9.氢氧燃料电池是将H2和O2分别通入电池,穿过浸入20%-40%的KOH溶液的多孔碳电极,其电极反应式为:H2+2OH--2e-═2H2O和$\frac{1}{2}$O2+H2O+2e-═2OH-则下列叙述正确的是( )
| A. | 通H2的极是正极,通入O2的极是负极 | |
| B. | 通O2的极是正极,通入H2的极是负极 | |
| C. | 工作一段时间后电解质溶液碱性增强 | |
| D. | 工作时负极区附近碱性不变 |
7.酸根RO3-所含电子数比硝酸根NO3-的电子数多10,则下列说法正确的是( )
| A. | R和N元素的原子含有相同数目的未成对电子 | |
| B. | RO3-中R的化合价与NO3-中的N的化合价不相等 | |
| C. | RO3-和NO3-只能被还原,不能被氧化 | |
| D. | R原子的电子层数比N的电子层数多1 |
