题目内容
7.利用铜和硝酸银反应原理设计一个原电池,此电池负极材料为Cu,负极的电极反应Cu-2e-=Cu2+;,正极材料为石墨,正极的电极反应2Ag++2 e-=2Ag.将锌片、铜片连接后浸入稀硫酸溶液中,工作一段时间,锌片质量减少3.25克,铜片表面析出氢气1.12升(标准状况下),导线中通过0.1摩尔电子.分析 铜和硝酸银反应生成硝酸铜和金属银,可以根据金属的活泼性判断正负极,根据电极上发生反应的类型确定电极反应式;将锌片、铜片连接后浸入稀硫酸溶液中,金属锌是负极,发生失去电子的氧化反应,在正极上是氢离子得电子的还原反应,根据电极反应式结合电子守恒进行计算即可.
解答 解:(1)铜和硝酸银反应生成硝酸铜和金属银,Cu+2AgNO3=Cu(NO3)2+Ag,可以判断此电池负极材料为Cu,电极反应式为:Cu-2e-=Cu2+;正极材料为石墨或是活泼性比Cu弱的金属,电极反应式为:2Ag++2 e-=2Ag,将锌片、铜片连接后浸入稀硫酸溶液中,金属锌是负极,发生失去电子的氧化反应:Zn-2e-=Zn2+,锌片质量减少3.25克即0.05mol,转移电子是0.1mol,在正极上是氢离子得电子的还原反应,2H++2e-=H2↑,此电极上产生氢气是0.05mol,标况下,体积是0.05mol×22.4L/mol=1.12L,
故答案为:Cu;Cu-2e-=Cu2+;石墨;2Ag++2 e-=2Ag;1.12;0.1.
点评 本题考查原电池工作原理知识,侧重于学生的分析能力的考查,注意把握原电池电极方程式的书写,学习中注意相关基础知识的积累,难度不大.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
19.向下列溶液中通入氯气,现象和结论描述正确的是( )
| A. | 品红溶液:红色褪去,加热该褪色溶液,仍无色:氯气具有漂白性 | |
| B. | 紫色石蕊溶液:先变红,后褪色;氯气与水反应生成盐酸和次氯酸 | |
| C. | 含酚酞的氢氧化钠溶液:红色褪去;氯气只作氧化剂 | |
| D. | 硫化钠溶液:溶液变浑浊;氯气只作还原剂 |
18.短周期元素X、Y、Z、W原子序数依次增大,它们原子的最外层电子数之和为14.X与Z同主族,Y与W同主族,且X的原子半径小于Y.下列叙述正确的是( )
| A. | 原子半径:Y<Z<W | |
| B. | Z在化合物中呈+1价 | |
| C. | Y与W可形成离子化合物 | |
| D. | W的单质能在Y的单质中燃烧生成WY3 |
2.危险化学品的包装标签上要印有警示标志.下列物质选用“腐蚀品”标志的是( )
| A. | 汽油 | B. | 食盐 | C. | 浓硫酸 | D. | 蔗糖 |

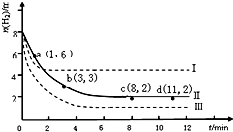
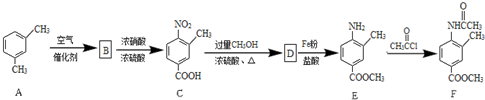
 .
. .
.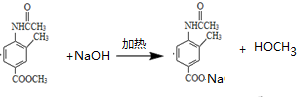 .
.