题目内容
7.酸根RO3-所含电子数比硝酸根NO3-的电子数多10,则下列说法正确的是( )| A. | R和N元素的原子含有相同数目的未成对电子 | |
| B. | RO3-中R的化合价与NO3-中的N的化合价不相等 | |
| C. | RO3-和NO3-只能被还原,不能被氧化 | |
| D. | R原子的电子层数比N的电子层数多1 |
分析 酸根RO3-所含电子数比硝酸根NO3-的电子数多10,则R中电子数比N原子电子数多10,所以R核外电子数为17,原子中核外电子数等于原子序数,则R为Cl元素,以此来解答.
解答 解:酸根RO3-所含电子数比硝酸根NO3-的电子数多10,则R中电子数比N原子电子数多10,所以R核外电子数为17,原子中核外电子数等于原子序数,则R为Cl元素,
A.R的3p电子数为5,只有1个未成对电子,而N元素的原子2p电子数为3,有3个未成对电子,故A错误;
B.RO3-中R的化合价与NO3-中的N的化合价均为+5价,故B错误;
C.RO3-中R的化合价为中间价,可被氧化或还原,而NO3-中的N的化合价为最高价,只能被还原,故C错误;
D.R原子有3个电子层、N原子有2个电子层,R原子的电子层数比N的电子层数多1,故D正确;
故选D.
点评 本题考查原子结构与元素的性质,为高频考点,把握电子数、质子数的关系推断元素为解答的关键,侧重分析与应用能力的考查,注意未成对电子及性质的判断,题目难度不大.

练习册系列答案
相关题目
18.以下表示氦原子结构的化学用语中,对电子运动状态描述最详细的是( )
| A. | :He | B. |  | C. | 1s2 | D. |  |
15.如表是元素周期表的一部分,针对表中的①~⑧种元素,填写下列空白:
(用元素符号或化学式作答)
(1)在这些元素中,化学性质最不活泼的是Ar;
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,
(3)形成化合物种类最多的元素是C;
(4)它们的氢化物分子间存在氢键的氢化物分子式是NH3、H2O
(5)在这些元素中,最活泼的金属在空气中加热反应的产物溶于水时反应的离子方程式为:2Na2O2+2H2O═4Na++4OH-+O2↑.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在这些元素中,化学性质最不活泼的是Ar;
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,
(3)形成化合物种类最多的元素是C;
(4)它们的氢化物分子间存在氢键的氢化物分子式是NH3、H2O
(5)在这些元素中,最活泼的金属在空气中加热反应的产物溶于水时反应的离子方程式为:2Na2O2+2H2O═4Na++4OH-+O2↑.
2.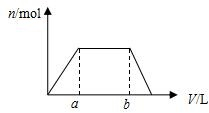 将足量CO2通入100mLKOH和Ca(OH)2的混合溶液中,生成沉淀的物质的量(n)和通入标况下CO2体积(V)的关系如图所示,则混合溶液中KOH的物质的量浓度为( )
将足量CO2通入100mLKOH和Ca(OH)2的混合溶液中,生成沉淀的物质的量(n)和通入标况下CO2体积(V)的关系如图所示,则混合溶液中KOH的物质的量浓度为( )
 将足量CO2通入100mLKOH和Ca(OH)2的混合溶液中,生成沉淀的物质的量(n)和通入标况下CO2体积(V)的关系如图所示,则混合溶液中KOH的物质的量浓度为( )
将足量CO2通入100mLKOH和Ca(OH)2的混合溶液中,生成沉淀的物质的量(n)和通入标况下CO2体积(V)的关系如图所示,则混合溶液中KOH的物质的量浓度为( )| A. | 10(b-a)/22.4 mol/L | B. | 20(b-a)/22.4 mol/L | ||
| C. | 10b/22.4 mol/L | D. | 10a/22.4 mol/L |
12.一定量的铝铁合金与300毫升2摩/升的HNO3完全反应,生成3.36升NO(标准状况)和三价铁盐、铝盐,固体无剩余,再向反应后的溶液中加入3摩/升NaOH溶液,使铝、铁元素完全沉淀下来,则加入的NaOH的体积是( )
| A. | 150mL | B. | 200mL | C. | 450mL | D. | 无法计算 |
11.1g H2的热值为142.9KJ热量,下列反应的热化学方程式正确的是( )
| A. | H2+O2═2H2O△H=-571.6KJ/mol | |
| B. | H2 (g)+$\frac{1}{2}$O2(g)═H2O (l)△H=-142.9KJ/mol | |
| C. | H2 (g)+$\frac{1}{2}$O2(g)═H2O (l)△H=-285.8KJ/mol | |
| D. | 2H2(g)+O2(g)═2H2O (g)△H=-571.6KJ/mol |
 .
. .
. .
.