题目内容
11.下列有关NaHS03溶液的叙述正确的是( )| A. | 该溶液中,K+、Ca2+、Cl2、Br -可以大量共存 | |
| B. | 与足量Ca( OH)2溶液反应的离子方程式:Ca2++OH-+HS03═CaS03↓+H20 | |
| C. | 与FeCI3溶液反应的离子方程式:SO32-+2 Fe3++H20═SO42-+2Fe2++2H+ | |
| D. | 能使含I2的淀粉溶液蓝色褪去,说明NaHSO3溶液具有漂白性 |
分析 A.氯气具有强的氧化性,能够氧化亚硫酸氢根离子;
B.氢氧化钙过量,反应生成亚硫酸根和水、氢氧化钠;
C.亚硫酸根离子能被三价铁离子氧化;
D.碘单质能够氧化亚硫酸氢根离子.
解答 解:A.氯气具有强的氧化性,能够氧化亚硫酸氢根离子,所以不能共存,故A错误;
B.与足量Ca( OH)2溶液反应的离子方程式:Ca2++OH-+HS03═CaS03↓+H20,故B正确;
C.与FeCI3溶液反应的离子方程式:HSO3-+H2O+2Fe3+═SO42-+2Fe2++3H+,故C错误;
D.亚硫酸氢根离子具有还原性,能够还原碘,使蓝色的碘的淀粉溶液褪色,故D错误;
故选:B.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意离子反应遵循客观事实、遵循原子个数、电荷数守恒规律,题目难度不大.

练习册系列答案
相关题目
2.下列关于化学观或化学研究方法的叙述中,错误的是( )
| A. | 在化工生产中应遵循“绿色化学”的思想 | |
| B. | 在元素周期表的过渡元素中寻找优良的催化剂 | |
| C. | 汽车尾气中产生NO的原因是空气中的N2与O2在汽车汽缸内的高温环境下发生反应的产物 | |
| D. | 根据元素周期律,由HClO4可以类推出氟元素也存在最高价氧化物的水化物HFO4 |
6.晶体硅是一种重要的非金属材料,模拟制备纯硅的主要步骤如下:
②高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl$\frac{\underline{\;300℃\;}}{\;}$SiHCl3+H2,
③SiHCl3与过量H2在1000~1100℃反应制得纯硅
可能用到的信息如下:
已知SiHCl3能与H2O强烈反应,在空气中易自燃;
步骤②中粗硅与HCl反应时会生成少量SiCl4;
请回答下列问题:
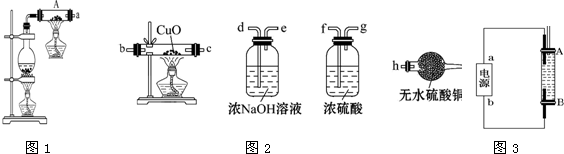
(1)粗硅与HCl反应完全后,依据上表所示沸点差异提纯SiHCl3.该提纯方法为分馏.
(2)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
①依次连接的合理顺序为DBCAE;;
装置D中g管的作用是平衡压强;
装置B中的试剂是浓硫酸;
装置C中的烧瓶加热的目的是使滴入烧瓶中的SiHCl3气化.
②装置A中发生反应的化学方程式为SiHCl3+H2$\frac{\underline{\;1000℃-1100℃\;}}{\;}$Si+3HCl.
③操作时应先打开装置D(C或D)中分液漏斗的旋塞,理由是:因为SiHCl3容易在空气自燃,实验中还要注意先通一段时间H2排尽装置中的空气.
(3)请设计实验证明产品硅中是否含微量铁单质:将产品用稀盐酸溶解,取上层清液后先滴加氯水,再滴加硫氰化钾溶液,溶液显红色.
②高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl$\frac{\underline{\;300℃\;}}{\;}$SiHCl3+H2,
| 沸点/℃ | |
| SiHCl3 | 33.0 |
| SiCl4 | 57.6 |
| HCl | -84 |
可能用到的信息如下:
已知SiHCl3能与H2O强烈反应,在空气中易自燃;
步骤②中粗硅与HCl反应时会生成少量SiCl4;
请回答下列问题:
(1)粗硅与HCl反应完全后,依据上表所示沸点差异提纯SiHCl3.该提纯方法为分馏.
(2)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):

①依次连接的合理顺序为DBCAE;;
装置D中g管的作用是平衡压强;
装置B中的试剂是浓硫酸;
装置C中的烧瓶加热的目的是使滴入烧瓶中的SiHCl3气化.
②装置A中发生反应的化学方程式为SiHCl3+H2$\frac{\underline{\;1000℃-1100℃\;}}{\;}$Si+3HCl.
③操作时应先打开装置D(C或D)中分液漏斗的旋塞,理由是:因为SiHCl3容易在空气自燃,实验中还要注意先通一段时间H2排尽装置中的空气.
(3)请设计实验证明产品硅中是否含微量铁单质:将产品用稀盐酸溶解,取上层清液后先滴加氯水,再滴加硫氰化钾溶液,溶液显红色.
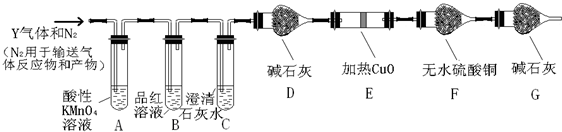
3.催化技术可处理汽车尾气:2NO+2CO?2CO2+N2,某温度下在容积不变的密闭容器中通入NO 和CO,不同时间NO 和CO 的浓度如下表.下列说法中不正确的是( )
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-3 mol•L-1 | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
| c(CO)/×10-3 mol•L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
| A. | 2 s 内的平均反应速率υ(N2)=1.875×10-4 mol•L-1•s-1 | |
| B. | 在该温度下K=5 | |
| C. | 若将容积缩小为原来的一半,NO 转化率大于90% | |
| D. | 某时刻再充入0.1 mol NO,0.36 mol CO,重新达平衡后CO 浓度比原平衡大 |
2.下列有关实验装置进行的相应实验,能达到实验目的是( )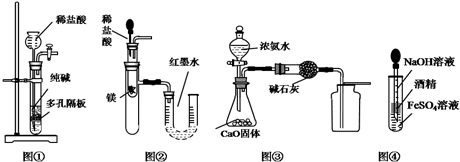

| A. | 用图①所示装置制取少量纯净的CO2气体 | |
| B. | 用图②所示装置验证镁和盐酸反应的热效应 | |
| C. | 用图③所示装置制取并收集干燥纯净的NH3 | |
| D. | 用图④装置制备Fe(OH)2并能保证较长时间观察到白色 |
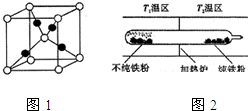
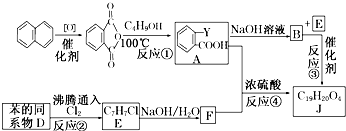
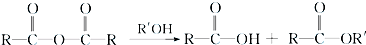
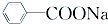 +RCl→
+RCl→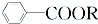 +NaCl;
+NaCl; .
. .
. .
.