题目内容
19.按如图1所示装置进行铁和水蒸气反应的实验.(1)铁粉与水蒸气反应的化学方程式是:Fe+4H2O(g) $\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(2)为检验生成的气体产物,需从图2选择必要的装置,其正确的连接顺序为(用接口字母表示)a-a-f-g-b-c-h,描述能验证气体产物的实验现象黑色的氧化铜变成红色,白色的无水硫酸铜变成蓝色;
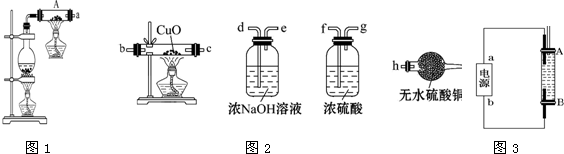
(3)停止反应,待装置冷却后,取出反应过的铁粉混合物,加入过量的稀硫酸充分反应,过滤.简述检验所得滤液中Fe3+的操作方法:取少量滤液与试管中,滴入几滴KSCN溶液,若溶液变血红色,证明含有铁离子,否则无铁离子;
(4)经检验上述滤液中不含Fe3+,这不能说明铁粉与水蒸气反应所得产物中不含+3价的铁.原因是(用离子方程式说明):2Fe3++Fe=3Fe2+;
(5)某同学利用上述滤液制取白色的Fe(OH)2沉淀,向滤液中加入NaOH溶液后,观察到生成的白色沉淀迅速变成灰绿色,最后变成红褐色.
①沉淀由白色变为红褐色的化学方程式是:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
②为了得到白色的Fe(OH)2沉淀,并尽可能使沉淀长时间保持白色,有同学设计如图3所示的装置:通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是ABD(填序号).
A.电源中的a为正极,b为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是2H++2e-═H2↑
分析 (1)在高温下,铁粉和水蒸气反应,产物有四氧化三铁和氢气;
(2)生成的气体产物为氢气,氢气与氧化铜反应生成水,氢气与氧化铜反应之前要干燥,根据氧化铜、无水硫酸铜颜色变化可以验证;
(3)检验滤液中是否含有Fe3+的简单方法是滴入几滴KSCN溶液,观察溶液是否变红色;
(4)反应生成四氧化三铁可以与稀硫酸发生反应Fe3O4+8H+=Fe2++2Fe3++4H2O,若铁粉过量,还可以和铁离子反应生成亚铁离子,所以滤液中可能含有铁离子,也可能不含有铁离子;
(5)①氢氧化亚铁不稳定接触空气时很快被氧化为氢氧化铁;
②要较长时间观察到氢氧化亚铁的白色沉淀,关键是怎样降低反应体系中氧气的量,利用生成的氢气赶净装置中的氧气,氢气应在B电极产生;
解答 解:(1)在高温下,铁粉和水蒸气反应生成四氧化三铁和氢气,反应的化学方程式为:Fe+4H2O(g) $\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
故答案为:Fe+4H2O(g) $\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(2)将产生的气体干燥后再与氧化铜反应生成铜单质和水,无水硫酸铜遇水变蓝色,所以实验装置连接顺序为:a→f→g→b→c→h,能验证气体为氢气的实验现象是:黑色的氧化铜变成红色,白色的无水硫酸铜变成蓝色,
故答案为:a-f-g-b-c-h;黑色的氧化铜变成红色,白色的无水硫酸铜变成蓝色;
(3)检验滤液中是否含有Fe3+的简单方法是:滴入几滴KSCN溶液,观察溶液是否变红色,若溶液变红色证明含有Fe3+,否则不含;
故答案为:取少量滤液与试管中,滴入几滴KSCN溶液,若溶液变血红色,证明含有铁离子,否则无铁离子;
(4)反应生成四氧化三铁可以与稀硫酸发生反应Fe3O4+8H+=Fe2++2Fe3++4H2O,若铁粉过量,还可以和铁离子反应:2Fe3++Fe=3Fe2+,生成亚铁离子,所以滤液中可能含有铁离子,也可能不含有铁离子,
故答案为:2Fe3++Fe=3Fe2+;
(5)①氢氧化亚铁不稳定接触空气时很快被氧化为氢氧化铁,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
②要较长时间观察到氢氧化亚铁的白色沉淀,关键是怎样降低反应体系中氧气的量,利用生成的氢气赶净装置中的氧气,氢气应在B电极产生.
A.产生氢气的电极应为阴极,电源中的a为正极,b为负极,故A正确;
B.可以用NaCl溶液作为电解液,阴极产生氢氧化钠与阳极产生的亚铁离子生成氢氧化亚铁,故B正确;
C.阳极用铁作电极,阴极不一定要用铁作电极,故C错误;
D.阴极是氢离子得电子生成氢气,电极反应式是2H++2e-═H2↑,故D正确,
故选:ABD.
点评 本题考查物质探究与制备实验、常见离子检验、电解原理应用等,关键是对实验原理的理解,熟练掌握元素化合物性质,难度中等.

 考前必练系列答案
考前必练系列答案①炽热的木炭 ②H2S气体 ③Cu ④FeO ⑤NH3 ⑥蔗糖 ⑦CuSO4•5H2O ⑧铁、铝.
| A. | ③④ | B. | ①②⑤⑧ | C. | ①②③④⑦ | D. | ⑥⑦ |
| 操作和现象 | 结 论 | |
| A | 向盛有2mL0.1mol/LAgNO3溶液的试管中,先滴几滴0.1mol/LKCl溶液,再滴加0.1mol/LKI溶液.试管中先出现白色沉淀,后出现淡黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4溶液颜色基本不变 | Fe(NO3)2与H2SO4不反应 |
| C | 在分液漏斗中加入碘水后再加入CCl4,充分振荡,分层,下层溶液呈紫色 | CCl4可作为碘的萃取剂 |
| D | 测定饱和NaClO溶液、CH3COONa溶液的pH,pH(NaClO)>pH(CH3COONa) | 弱酸的酸性:HClO<CH3COOH |
| A. | A | B. | B | C. | C | D. | D |
| A. | 该溶液中,K+、Ca2+、Cl2、Br -可以大量共存 | |
| B. | 与足量Ca( OH)2溶液反应的离子方程式:Ca2++OH-+HS03═CaS03↓+H20 | |
| C. | 与FeCI3溶液反应的离子方程式:SO32-+2 Fe3++H20═SO42-+2Fe2++2H+ | |
| D. | 能使含I2的淀粉溶液蓝色褪去,说明NaHSO3溶液具有漂白性 |
| A. | W分子中碳、氢质量比为1:2 | B. | W同分异构体有5种 | ||
| C. | 经红外光谱测定W最多有4个甲基 | D. | 在核磁共振氢谱中W最少有2个峰 |
 .
. .
. .
.