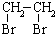题目内容
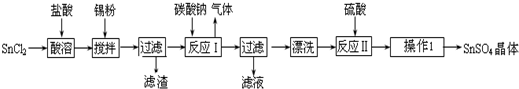
1.实验目的:为研究铁质材料与热浓硫酸的反应(1)称取铁钉(碳素钢)12.0g放入30.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y.
①甲同学认为X中除Fe3+外还可能含有Fe2+.若要确认其中是否含有Fe2+,应选择加入的试剂为d(选填序号)
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.酸性KMnO4溶液
②乙同学取672mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O=2HBr+H2SO4然后加入足量BaCl2溶液,经适当操作后得到干燥固体4.66g.据此推知气体Y 中SO2的体积分数为66.7%.
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和CO2气体.为此设计了下列探究实验装置(图中夹持仪器省略).
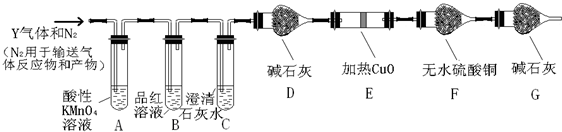
(2)气体Y中还有H2的原因是H2SO4変稀后与Fe生成H2.
(3)装置A中试剂的作用是除去混合气体中的SO2,反应的离子方程式5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+.
(4)简述确认气体Y中含有CO2的实验现象B中品红不褪色且C中澄清的石灰水变浑浊.
(5)如果气体Y中含有H2,预计实验现象应是E中固体由黑变红和F中固体变蓝.
分析 (1)①Fe2+具有还原性,可与高锰酸钾发生氧化还原反应;
②气体通入足量溴水中,然后加入足量BaCl2溶液,最终干燥得到固体4.66g为BaSO4的,根据S元素守恒计算二氧化硫的体积,进而计算其体积分数;
(2)铁钉放入浓硫酸中,加热先生成二氧化硫,随着反应的进行,浓硫酸变为稀硫酸,铁与稀硫酸反应生成氢气;
(3)用澄清石灰水检验二氧化碳,二氧化硫和二氧化碳都能使澄清石灰水变浑浊,可用酸性高锰酸钾除去,用品红溶液检验二氧化硫是否除尽,D中碱石灰干燥气体,根据E、F中颜色变化判断是否有氢气,G中碱石灰防止空气中水蒸气进入F中;
(4)B中的品红不褪色,说明不含二氧化硫,C中石灰水变浑浊说明有二氧化碳气体;
(5)氢气与氧化铜反应生成红色的Cu与水,无水硫酸铜吸水变蓝色.
解答 解:(1)①Fe2+具有还原性能使酸性高锰酸钾褪色,所以可以酸性高锰酸钾检验是否含有Fe2+,
故答案为:d;
②气体通入足量溴水中,然后加入足量BaCl2溶液,最终干燥得到固体4.66g为BaSO4的,根据S元素守恒,n(SO2)=n(BaSO4)=$\frac{4.66g}{233g/mol}$=0.02mol,二氧化硫的体积分数为$\frac{0.02mol×22.4L/mol}{0.672L}$×100%=66.7%,
故答案为:66.7%;
(2)铁钉放入浓硫酸中,加热先生成二氧化硫,随着反应的进行,浓硫酸变为稀硫酸,铁与稀硫酸反应生成氢气,
故答案为:H2SO4変稀后与Fe生成H2;
(3)用澄清石灰水检验二氧化碳,二氧化硫和二氧化碳都能使澄清石灰水变浑浊,可用酸性高锰酸钾除去,反应离子方程式为:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+,用品红溶液检验二氧化硫是否除尽,D中碱石灰干燥气体,根据E、F中颜色变化判断是否有氢气,G中碱石灰防止空气中水蒸气进入F中,
故答案为:除去混合气体中的SO2; 5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
(4)B中的品红不褪色,说明不含二氧化硫,C中石灰水变浑浊说明有二氧化碳气体,
故答案为:B中品红不褪色且C中澄清的石灰水变浑浊;
(5)氢气能还原氧化铜,使氧化铜变红;氧化产物是水,所以无水硫酸铜变蓝,E中固体由黑变红和F中固体变蓝可以说明含有氢气,
故答案为:E中固体由黑变红和F中固体变蓝.
点评 本题考查综合实验探究,注意二氧化硫会影响二氧化碳的检验,要确保检验二氧化碳前除尽二氧化硫,(4)中现象描述容易忽略B中品不褪色,题目难度中等.

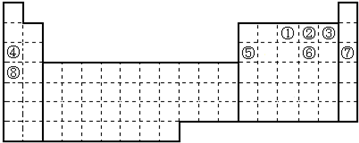
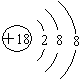
①炽热的木炭 ②H2S气体 ③Cu ④FeO ⑤NH3 ⑥蔗糖 ⑦CuSO4•5H2O ⑧铁、铝.
| A. | ③④ | B. | ①②⑤⑧ | C. | ①②③④⑦ | D. | ⑥⑦ |
| 操作和现象 | 结 论 | |
| A | 向盛有2mL0.1mol/LAgNO3溶液的试管中,先滴几滴0.1mol/LKCl溶液,再滴加0.1mol/LKI溶液.试管中先出现白色沉淀,后出现淡黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4溶液颜色基本不变 | Fe(NO3)2与H2SO4不反应 |
| C | 在分液漏斗中加入碘水后再加入CCl4,充分振荡,分层,下层溶液呈紫色 | CCl4可作为碘的萃取剂 |
| D | 测定饱和NaClO溶液、CH3COONa溶液的pH,pH(NaClO)>pH(CH3COONa) | 弱酸的酸性:HClO<CH3COOH |
| A. | A | B. | B | C. | C | D. | D |
| A. | 该溶液中,K+、Ca2+、Cl2、Br -可以大量共存 | |
| B. | 与足量Ca( OH)2溶液反应的离子方程式:Ca2++OH-+HS03═CaS03↓+H20 | |
| C. | 与FeCI3溶液反应的离子方程式:SO32-+2 Fe3++H20═SO42-+2Fe2++2H+ | |
| D. | 能使含I2的淀粉溶液蓝色褪去,说明NaHSO3溶液具有漂白性 |
 .
.

 .
.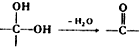
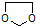
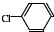 中氯原子较难水解物质A(
中氯原子较难水解物质A( 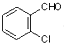 )可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式
)可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式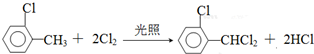 、
、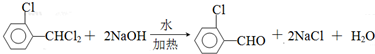 .该合成的第一步主要存在产率低的问题,请写出该步可能存在的有机物杂质的结构简式
.该合成的第一步主要存在产率低的问题,请写出该步可能存在的有机物杂质的结构简式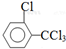 、
、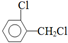 .
.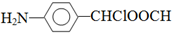 .
.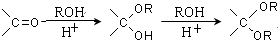
 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下: