题目内容
1.下面a~e是中学化学实验中常见的几种定量仪器:(a)量筒 (b)容量瓶 (c)滴定管 (d)托盘天平 (e)温度计
(1)无“0”刻度的是ab(填写编号).
(2)下列操作能合理的是A
A.用25mL碱式滴定管量取20.00mLNaHCO3
B.用托盘天平准确称量10.20克碳酸钠固体
C.用100mL量筒量取3.2mL浓硫酸
D.用500mL容量瓶配制1mol•L-1的氢氧化钠溶液495.5mL
(3)某学生根据三次实验分别记录有关数据如下表:
| 滴定次数 | 待测氢氧化钠溶液的体积(ml) | 0.1000mol?L-1盐酸的体积(ml) |
| 第一次 | 25.00 | 26.11 |
| 第二次 | 25.00 | 28.74 |
| 第三次 | 25.00 | 26.09 |
(4)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是CD(填写编号).
A.中和滴定达终点时俯视滴定管内液面读数.
B.碱式滴定管用蒸馏水洗净后立即取用25.00ml待测碱溶液注入锥形瓶进行滴定.
C.酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定.
D.把配好的标准溶液倒入刚用蒸馏水洗净的试剂瓶中然后用来滴定.
分析 (1)量筒小刻度在下,故不需要0刻度;容量瓶只有一个量程刻度;
(2)A.滴定管可以读数读到0.01ml;B.托盘天平只能读数到0.1g;C.选择的量筒规格不合理;D.实验室没有495.5mL容量瓶;
(3)依据图表数据求出1、2组平均消耗V(盐酸),接着根据盐酸和NaOH反应求出C(NaOH先根据数据的有效性,舍去第2组数据,然后求出1、3组平均消耗V(盐酸),接着根据盐酸和NaOH反应求出C(NaOH);
(4)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)×的影响,以此判断浓度的误差.
解答 解:(1)量筒小刻度在下,故不需要0刻度;容量瓶只有一个量程刻度;滴定管、托盘天平、温度计均有0刻度,
故答案为:ab;
(2)A.碳酸氢钠为强碱弱酸盐,溶液呈碱性,滴定管可以读数读到0.01mL,可用25mL碱式滴定管量取20.00mLNaHCO3,故A正确;
B.用托盘天平准确称量10.20克碳酸钠固体,不符合托盘天平只能读数到0.1g,故B错误;
C.用100mL量筒量取3.2mL浓硫酸,选择的量筒规格不合理,故C错误;
D.容量瓶只有一个刻度,实验室没有495.5mL容量瓶,故D错误;
故选A.
(3)根据数据的有效性,舍去第2组数据,则1、3组平均消耗V(盐酸)=$\frac{26.11mL+26.09mL}{2}$=26.10mL,
根据反应方程式 HCl+NaOH═NaCl+H2O
0.0261L×0.1000mol/L 0.025L×C(NaOH)
则C(NaOH)=$\frac{0.0261L×0.1000mol/L}{0.025L}$=0.1044mol/L,
故答案为:0.1044mol/L;
(4)A.读取盐酸体积时,滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$,可知,测定c(NaOH)偏低,故A错误;
B.碱式滴定管用蒸馏水洗净后立即取用25.00ml待测碱溶液注入锥形瓶进行滴定,相当于稀释,造成c(NaOH)偏低,故B错误;
C.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$,可知,测定c(NaOH)偏大,故C正确;
D.把配好的标准溶液倒入刚用蒸馏水洗净的试剂瓶中标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$,可知,测定c(NaOH)偏大,故D正确;
故选CD.
点评 本题考查了常用仪器的使用、中和滴定操作、误差分析以及计算,难度不大,理解中和滴定的原理是解题关键.

 阅读快车系列答案
阅读快车系列答案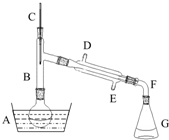 溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:NaBr+H2SO4=NaHSO4+HBr
溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:NaBr+H2SO4=NaHSO4+HBrCH3CH2OH+HBr $\stackrel{硫酸}{→}$CH3CH2Br+H2O
某课外小组欲在实验室制备溴乙烷的装置如图.数据如下表.
| 物质 数据 | 乙醇 | 溴乙烷 | 1,2-二溴乙烷 | 乙醚 | 浓硫酸 |
| 密度/g•cm-3 | 0.79 | 1.46 | 2.2 | 0.71 | 1.84 |
| 熔点(℃) | -130 | -119 | 9 | -116 | 10 |
| 沸点(℃) | 78.5 | 38.4 | 132 | 34.6 | 338 |
| 在水中的溶解度(g) | 互溶 | 0.914 | 1 | 7.5 | 互溶 |
(1)加入药品之前须做的操作是检查装置的气密性.
(2)仪器B的作用是除了使溴乙烷馏出,还有一个目的是冷凝回流.温度计的温度应控制在38.4℃~78.5℃;冷却水的流向应为E进D出(填“D进E出”或“E进D出”)
(3)反应时有可能生成SO2和一种红棕色气体,可选择NaOH溶液分别除去这些气体,有关的离子方程式是SO2+2OH-=SO32-+H2O、Br2+2OH-=Br-+BrO-+H2O.
(4)实验中采用80%硫酸,而不能用98%浓硫酸,一方面是为了减少副反应(如避免HBr被氧化),另一方面是为了防止溴化氢气体的挥发.
 某同学用0.1082mol/L的NaOH溶液滴定未知浓度的盐酸.
某同学用0.1082mol/L的NaOH溶液滴定未知浓度的盐酸.以下是实验数据记录表:
| 实验序号 | 待测盐酸溶液体积(mL) | 滴定管读数 | 消耗标准NaOH溶液的体积(mL) | |
| 初读数 | 末读数 | |||
| 1 | 20.00 | 0.00 | 19.90 | 19.90 |
| 2 | 20.00 | 0.05 | ||
(2)计算待测盐酸溶液浓度.
| A. | 在标准状况下,1L庚烷完全燃烧后,所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 1mol碳正离子CH5+所含的电子数为10NA | |
| C. | 56g铁粉在1mol氯气中充分燃烧,失去的电子数为3NA | |
| D. | 0.5molC3H8分子中含C-H共价键2NA |
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 390 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 390 | |||
| Ⅲ | 230 | 0.20 | 0.090 | 0.090 |
(1)反应的△H<O (填“>”或“<”);判断的理由是投料量相同时,温度高的容器,平衡时二甲醚的物质的量小,说明反应为放热反应,△H小于0.
(2)容器I到达平衡所需的时间为20s,反应速率v(CH3OH)为0.004mol/(L•s).390℃时该反应的平衡常数K1=4(填数值).
(3)容器II达平衡时,压强是容器I的两倍,CH3OH的体积分数和容器I中的相同,CH3OH起始的物质的量为0.40mol;平衡时CH3OH(g)的体积分数为20%.
(4)390℃,若向3L容器中充入0.9mol CH3OH(g),0.6mol CH3OCH3(g)和0.3molH2O(g),则起始时该反应速率V正>V逆.(填“>”“<”或“=”)
| A. | 正反应速率增大,逆反应速率减小,平衡向正向移动 | |
| B. | 逆反应速率增大,正反应速率减小,平衡逆向移动 | |
| C. | 正、逆反应速率都增大,平衡不移动 | |
| D. | 正、逆反应速率都增大,平衡向正反应方向移动 |
| A. | CuCl2( H2O) | B. | NaOH(Na2O) | C. | CuSO4( CuO) | D. | NaCl( NaOH) |
 ;
;