题目内容
6.用NA表示阿伏加德常数,下列叙述中正确的是( )| A. | 在标准状况下,1L庚烷完全燃烧后,所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 1mol碳正离子CH5+所含的电子数为10NA | |
| C. | 56g铁粉在1mol氯气中充分燃烧,失去的电子数为3NA | |
| D. | 0.5molC3H8分子中含C-H共价键2NA |
分析 A.庚烷标况下不是气态;
B.碳正离子(CH5+)所含的电子总数为6+5-1=10;
C.56g铁粉即1mol铁粉在1mol氯气中燃烧,铁粉过量;
D.丙烷分子中含C-H键8个.
解答 解:A.标况下庚烷不是气体,不能使用标况下的气体摩尔体积计算1L庚烷的物质的量,故A错误;
B.1mol碳正离子CH5+含有10mol电子,所含的电子数为10NA,故B正确;
C.56g铁粉即1mol铁粉在1mol氯气中燃烧,铁粉过量,氯气完全反应,而由于氯气反应后变为-1价,故1mol氯气得2mol电子,则铁粉失去的电子为2mol,即为2NA个,故C错误;
D.0.5mol丙烷中含有4mol碳氢键,含C-H共价键4NA,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是物质结构分析,气体摩尔体积的应用条件理解,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
16.电解制金属锰的阳极泥中主要含有MnO2,MnO等.利用该阳极泥生产MnO2的工艺流程如下:
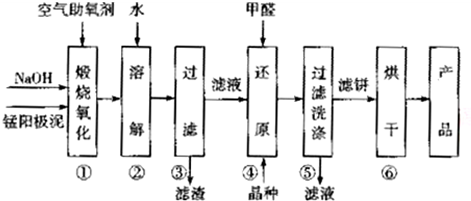
已知:①部分物质的溶解性或Ksp如表:
②Na2MnO4,在pH≤7的环境中,易歧化为MnO2和高锰酸钾.
回答下列问题:
(1)电解MnSO4溶液时,阴极为Mn2+得电子被还原为金属Mn,阳极反应式为2H2O-4e-=O2↑+4H+.
电解过程中溶液的pH不能过高,也不能过低,需要控制电解液的pH≈6.8,原因是pH过高,Mn2+生成Mn(OH)2,pH过低时,阴极上氢离子放电.
(2)步骤①中+2价Mn和+4价Mn均被氧化为Na2MnO4,写出该步骤中+2价Mn反应的化学方程式:MnO+2NaOH+O2$\frac{\underline{\;煅烧\;}}{\;}$Na2MnO4+H2O.
(3)步骤②一④均采用pH≈10的环境,目的是提高产品中Mn的转化率.
(4)步骤④中氧化剂与还原剂的物质的量之比为2:1,则氧化产物的化学式为CO2.该反应中除氧化产物和还原产物的另外一种生成物的化学式为NaOH.
(5)步骤⑥为烘干操作,所用的烘干设备可能是BD(填字母).
A.鼓风机 B.烘干机 C.压榨机 D.红外烘箱
(6)产率与步骤①煅烧温度的关系如图所示:
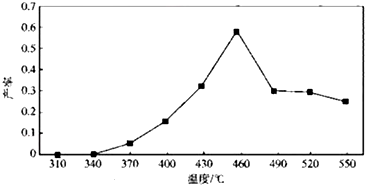
步骤①最好选用的煅烧温度约为B°C(填字母).
A.340 B.460 C.490 D.550.

已知:①部分物质的溶解性或Ksp如表:
| 物质 | MnSO4 | Mn(OH)2 | MnO2 |
| 溶解性或Ksp | 易溶 | 1.9×10-13 | 难溶 |
回答下列问题:
(1)电解MnSO4溶液时,阴极为Mn2+得电子被还原为金属Mn,阳极反应式为2H2O-4e-=O2↑+4H+.
电解过程中溶液的pH不能过高,也不能过低,需要控制电解液的pH≈6.8,原因是pH过高,Mn2+生成Mn(OH)2,pH过低时,阴极上氢离子放电.
(2)步骤①中+2价Mn和+4价Mn均被氧化为Na2MnO4,写出该步骤中+2价Mn反应的化学方程式:MnO+2NaOH+O2$\frac{\underline{\;煅烧\;}}{\;}$Na2MnO4+H2O.
(3)步骤②一④均采用pH≈10的环境,目的是提高产品中Mn的转化率.
(4)步骤④中氧化剂与还原剂的物质的量之比为2:1,则氧化产物的化学式为CO2.该反应中除氧化产物和还原产物的另外一种生成物的化学式为NaOH.
(5)步骤⑥为烘干操作,所用的烘干设备可能是BD(填字母).
A.鼓风机 B.烘干机 C.压榨机 D.红外烘箱
(6)产率与步骤①煅烧温度的关系如图所示:

步骤①最好选用的煅烧温度约为B°C(填字母).
A.340 B.460 C.490 D.550.
1.下面a~e是中学化学实验中常见的几种定量仪器:
(a)量筒 (b)容量瓶 (c)滴定管 (d)托盘天平 (e)温度计
(1)无“0”刻度的是ab(填写编号).
(2)下列操作能合理的是A
A.用25mL碱式滴定管量取20.00mLNaHCO3
B.用托盘天平准确称量10.20克碳酸钠固体
C.用100mL量筒量取3.2mL浓硫酸
D.用500mL容量瓶配制1mol•L-1的氢氧化钠溶液495.5mL
(3)某学生根据三次实验分别记录有关数据如下表:
请选用其中合理数据列出该氢氧化钠溶液物质的量浓度(计算结果小数点后保留4位数字):c(NaOH)=0.1044mol/L
(4)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是CD(填写编号).
A.中和滴定达终点时俯视滴定管内液面读数.
B.碱式滴定管用蒸馏水洗净后立即取用25.00ml待测碱溶液注入锥形瓶进行滴定.
C.酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定.
D.把配好的标准溶液倒入刚用蒸馏水洗净的试剂瓶中然后用来滴定.
(a)量筒 (b)容量瓶 (c)滴定管 (d)托盘天平 (e)温度计
(1)无“0”刻度的是ab(填写编号).
(2)下列操作能合理的是A
A.用25mL碱式滴定管量取20.00mLNaHCO3
B.用托盘天平准确称量10.20克碳酸钠固体
C.用100mL量筒量取3.2mL浓硫酸
D.用500mL容量瓶配制1mol•L-1的氢氧化钠溶液495.5mL
(3)某学生根据三次实验分别记录有关数据如下表:
| 滴定次数 | 待测氢氧化钠溶液的体积(ml) | 0.1000mol?L-1盐酸的体积(ml) |
| 第一次 | 25.00 | 26.11 |
| 第二次 | 25.00 | 28.74 |
| 第三次 | 25.00 | 26.09 |
(4)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是CD(填写编号).
A.中和滴定达终点时俯视滴定管内液面读数.
B.碱式滴定管用蒸馏水洗净后立即取用25.00ml待测碱溶液注入锥形瓶进行滴定.
C.酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定.
D.把配好的标准溶液倒入刚用蒸馏水洗净的试剂瓶中然后用来滴定.
18.下列有关实验的叙述正确的是( )
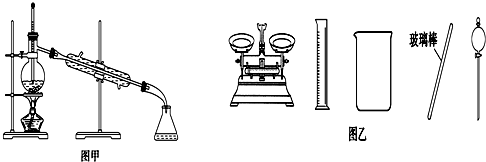

| A. | 闻未知液体气味时,应该将试剂瓶口距离口鼻远一些,用手轻轻扇动 | |
| B. | 将碘单质从碘的CCl4溶液中分离出来可用如图甲所示实验装置 | |
| C. | 用容量瓶配制好一定浓度的某溶液后,塞紧瓶塞并在容量瓶上贴上标签 | |
| D. | 配制500 mL 0.4 mol•L-1NaCl溶液,必要的仪器如图乙所示 |
16.下列有关阿佛加德罗常数(NA)的说法错误的是( )
| A. | 0.5molH2O含有的原子数目为1.5NA | B. | 0.5molNH3含有的电子数目为4NA | ||
| C. | 28gCO含有的分子数目为NA | D. | 2NA个氯气分子的物质的量是2mol |
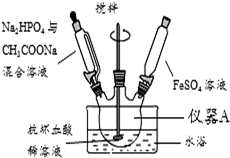 磷酸亚铁[Fe3(PO4)2•8H2O]为白蓝色晶体,溶于强酸,不溶于水、醋酸和乙醇.主要用于制造磷酸铁锂电池.实验室制备磷酸亚铁的装置示意图如图、反应和实验步骤如下.
磷酸亚铁[Fe3(PO4)2•8H2O]为白蓝色晶体,溶于强酸,不溶于水、醋酸和乙醇.主要用于制造磷酸铁锂电池.实验室制备磷酸亚铁的装置示意图如图、反应和实验步骤如下.