题目内容
11.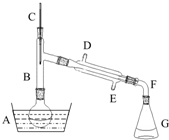 溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:NaBr+H2SO4=NaHSO4+HBr
溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:NaBr+H2SO4=NaHSO4+HBrCH3CH2OH+HBr $\stackrel{硫酸}{→}$CH3CH2Br+H2O
某课外小组欲在实验室制备溴乙烷的装置如图.数据如下表.
| 物质 数据 | 乙醇 | 溴乙烷 | 1,2-二溴乙烷 | 乙醚 | 浓硫酸 |
| 密度/g•cm-3 | 0.79 | 1.46 | 2.2 | 0.71 | 1.84 |
| 熔点(℃) | -130 | -119 | 9 | -116 | 10 |
| 沸点(℃) | 78.5 | 38.4 | 132 | 34.6 | 338 |
| 在水中的溶解度(g) | 互溶 | 0.914 | 1 | 7.5 | 互溶 |
(1)加入药品之前须做的操作是检查装置的气密性.
(2)仪器B的作用是除了使溴乙烷馏出,还有一个目的是冷凝回流.温度计的温度应控制在38.4℃~78.5℃;冷却水的流向应为E进D出(填“D进E出”或“E进D出”)
(3)反应时有可能生成SO2和一种红棕色气体,可选择NaOH溶液分别除去这些气体,有关的离子方程式是SO2+2OH-=SO32-+H2O、Br2+2OH-=Br-+BrO-+H2O.
(4)实验中采用80%硫酸,而不能用98%浓硫酸,一方面是为了减少副反应(如避免HBr被氧化),另一方面是为了防止溴化氢气体的挥发.
分析 (1)与气体有关的实验,加入药品之前须做的操作是:检查装置的气密性;
(2)装置B为竖立的试管,除了使溴乙烷馏出,还有一个目的是冷凝回流;溴乙烷的沸点为38.4℃,反应物乙醇的沸点为78.5℃,所以温度计的温度应控制在38.4℃与78.5℃之间.冷凝管采用逆流冷却效果好;
(3)SO2与NaOH反应生成Na2SO3和H2O,离子方程式为:SO2+2OH-=SO32-+H2O;红棕色气体为Br2,与NaOH反应的离子方程式为:Br2+2OH-=Br-+BrO-+H2O;
(4)98%浓硫酸具有吸水性,能加快溴化氢气体的挥发.
解答 解:(1)实验室制备溴乙烷,用95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末为原料,反应中有气体生成,且乙醇易挥发,所以在加入药品之前应进行的操作是:检查装置的气密性;
故答案为:检查装置的气密性;
(2)装置B的作用使乙醇蒸气回流到烧瓶中继续反应,溴乙烷的沸点为38.4℃,乙醇的沸点为78.5℃,让溴乙烷蒸发出,让乙醇冷凝回流,所以温度计的温度应控制在38.4℃~78.5℃,冷凝管采用逆流,这样温差大,冷却效果好,
故答案为:冷凝回流;38.4℃~78.5℃;E进D出;
(3)二氧化硫与氢氧化钠溶液反应生成亚硫酸钠和水,反应的化学方程式是:SO2+2NaOH═Na2SO3+H2O,离子反应为:SO2+2OH-=SO32-+H2O,溴能和氢氧化钠反应:Br2+2NaOH═NaBr+NaBrO+H2O,离子反应为:Br2+2OH-=Br-+BrO-+H2O,
故答案为:SO2+2OH-=SO32-+H2O;Br2+2OH-=Br-+BrO-+H2O;
(4)浓硫酸具有强氧化性,能氧化溴化氢,同时浓硫酸溶于水,放出大量的热,促进溴化氢气体的挥发,所以实验中采用浓度较低的80%硫酸,
故答案为:防止溴化氢气体的挥发.
点评 本题考查了溴乙烷的制取和性质,侧重考查了副产物的产生、去除等工艺,掌握相关的反应原理是解答的关键,注意卤代烃的性质,本题难度中等.

 期末集结号系列答案
期末集结号系列答案| A. | 标准状况下,a L的氧气和氮气的混合物含有的分子数约为$\frac{a}{22.4}$×6.02×1023 | |
| B. | 由1L 1 mol•L-1的 FeCl3溶液制成的胶体中胶粒总数小于NA个 | |
| C. | 2.3g金属钠变为钠离子失去0.1NA电子 | |
| D. | 2.24L CO2中含有的原子数为3×0.1×6.02×1023 |
| A. | NaOH固体称量时间过长 | B. | 盛放标准盐酸的滴定管用碱液润洗 | ||
| C. | 用酚酞作指示剂 | D. | 固体NaOH中含有Na2O杂质 |
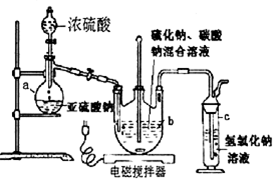
①开启分液漏斗,使硫酸慢慢滴下,适当调节螺旋夹,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电磁搅拌器搅动.
②至析出的硫不再消失,控制溶液的pH接近7时,停止通入SO2气体.
③抽滤所得的滤液,转移至蒸发皿中,水浴加热浓缩,直到溶液表面出现晶膜.
④冷却结晶、抽滤、洗涤.
⑤将晶体放入烘箱中,在40~45℃左右干燥50~60min,称量.
请回答以下问题:
(l)仪器a的名称是蒸馏烧瓶;
(2)步骤②中若控制pH值小于7,则产率会下降,请用离子方程式解释原因:S2O32-+2H+=S↓+H2O+SO2↑.
(3)步骤③中不能将溶液蒸发至干的原因是蒸干会使硫代硫酸钠脱水并分解;晶膜通常在溶液表面出现的原因是因为溶液表面温度较低.
(4)步骤④中洗涤硫代硫酸钠晶体所用试剂的结构式是
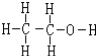 .
.(5)为检验制得的产品的纯度,该实验小组称取5,0克的产品配制成250mL硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入25mL 0.0lmol•L-1KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,当蓝色褪去H半分钟不变色时到达滴定终点.实验数据如下表:
| 实验序号 | 1 | 2 | 3 |
| Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.18 |
A.滴定管末用Na2S2O3溶液润洗 B.滴定终点时仰视读数
C.锥形瓶用蒸馏水润洗 D.滴定管尖嘴处滴定前无气泡,滴定终点发现气泡.
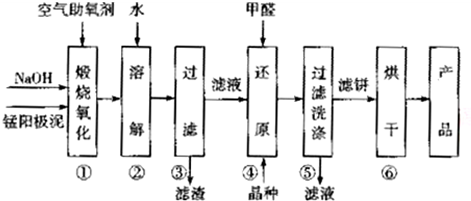
已知:①部分物质的溶解性或Ksp如表:
| 物质 | MnSO4 | Mn(OH)2 | MnO2 |
| 溶解性或Ksp | 易溶 | 1.9×10-13 | 难溶 |
回答下列问题:
(1)电解MnSO4溶液时,阴极为Mn2+得电子被还原为金属Mn,阳极反应式为2H2O-4e-=O2↑+4H+.
电解过程中溶液的pH不能过高,也不能过低,需要控制电解液的pH≈6.8,原因是pH过高,Mn2+生成Mn(OH)2,pH过低时,阴极上氢离子放电.
(2)步骤①中+2价Mn和+4价Mn均被氧化为Na2MnO4,写出该步骤中+2价Mn反应的化学方程式:MnO+2NaOH+O2$\frac{\underline{\;煅烧\;}}{\;}$Na2MnO4+H2O.
(3)步骤②一④均采用pH≈10的环境,目的是提高产品中Mn的转化率.
(4)步骤④中氧化剂与还原剂的物质的量之比为2:1,则氧化产物的化学式为CO2.该反应中除氧化产物和还原产物的另外一种生成物的化学式为NaOH.
(5)步骤⑥为烘干操作,所用的烘干设备可能是BD(填字母).
A.鼓风机 B.烘干机 C.压榨机 D.红外烘箱
(6)产率与步骤①煅烧温度的关系如图所示:
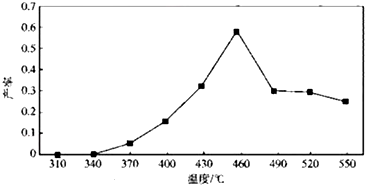
步骤①最好选用的煅烧温度约为B°C(填字母).
A.340 B.460 C.490 D.550.
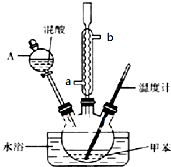 某实验小组用下图所示的装置制备一硝基甲苯(含邻硝基甲苯和对硝基甲苯):
某实验小组用下图所示的装置制备一硝基甲苯(含邻硝基甲苯和对硝基甲苯):反应原理:
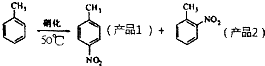
实验步骤:①配制浓硫酸与浓硝酸(按体积比1:3)的混合溶液(即混酸)40mL;
②在三颈瓶中加入15mL(13g)甲苯,
③按图所示装好药品,并装好其他仪器;
④向三颈瓶中加入混酸,并不断搅拌(磁力搅拌器以略去);
⑤控制温度约为50℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑥分离出一硝基甲苯.
实验中可能用到的数据:
| 密度g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 产品1 | 1.286 | 237.7 | 不溶于水,易溶于液体烃 |
| 产品2 | 1.162 | 222 | 不溶于水,易溶于液体烃 |
(1)配制40mL混酸的操作是将30mL浓硝酸注入烧杯中,再沿烧杯内壁注入10mL浓硫酸,边加边搅拌;
(2)本实验中浓硫酸的作用是催化剂、吸水剂;
(3)装置中仪器A使用前须清洗干净并检漏;
(4)分离产品的方案如下:

操作2必需的玻璃仪器共有6种.
(5)若最终得到产品1和产品2的总质量为17.42g,则一硝基甲苯的总产率是89.99%(保留两位小数)
| 物质 | 相对分子质量 | 密度/(g•mL-1) | 沸点/℃ | 水中溶解性 |
| CHCl3 | 119.5 | 1.50 | 61.3 | 难溶 |
| CCl4 | 154 | 1.59 | 76.7 | 难溶 |
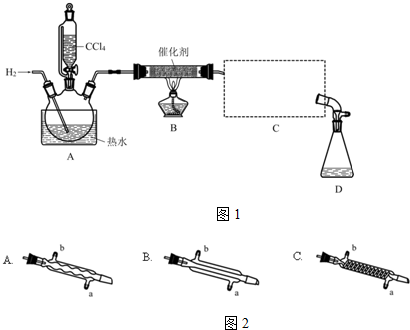
①检验装置气密性;
②开始通入H2;
③点燃B处酒精灯;
④向A处水槽中加入热水,接通C处冷凝装置的冷水;
⑤向三颈瓶中滴入20mLCCl4;
⑥反应结束后,停止加热,将D处锥形瓶中收集到的液体分别用适量NaHCO3溶液和水洗涤,分出的产物加入少量无水CaCl2固体,静置后过滤;
⑦对滤液进行蒸馏纯化,得到氯仿15g.请回答:
(1)若步骤②和步骤③的顺序颠倒,则实验中产生的不良后果可能为加热时氢气遇氧气发生爆炸;生成的氯仿被氧气氧化.
(2)B处中发生主要反应的化学方程式为CCl4+H2$→_{△}^{催化剂}$CHCl3+HCl.
(3)C处中应选用的冷凝管为如图2B(填选项字母);冷水应从该冷凝管的a(填“a”或“b”)口接入.
(4)步骤⑥中,用水洗涤的目的为洗掉NaHCO3和NaCl.
(5)该实验中,氯仿的产率为61%.
(6)氯仿在空气中能被氧气氧化生成HCl和光气(COCl2),该反应的化学方程式为2CHCl3+O2=2COCl2+2HCl.
(a)量筒 (b)容量瓶 (c)滴定管 (d)托盘天平 (e)温度计
(1)无“0”刻度的是ab(填写编号).
(2)下列操作能合理的是A
A.用25mL碱式滴定管量取20.00mLNaHCO3
B.用托盘天平准确称量10.20克碳酸钠固体
C.用100mL量筒量取3.2mL浓硫酸
D.用500mL容量瓶配制1mol•L-1的氢氧化钠溶液495.5mL
(3)某学生根据三次实验分别记录有关数据如下表:
| 滴定次数 | 待测氢氧化钠溶液的体积(ml) | 0.1000mol?L-1盐酸的体积(ml) |
| 第一次 | 25.00 | 26.11 |
| 第二次 | 25.00 | 28.74 |
| 第三次 | 25.00 | 26.09 |
(4)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是CD(填写编号).
A.中和滴定达终点时俯视滴定管内液面读数.
B.碱式滴定管用蒸馏水洗净后立即取用25.00ml待测碱溶液注入锥形瓶进行滴定.
C.酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定.
D.把配好的标准溶液倒入刚用蒸馏水洗净的试剂瓶中然后用来滴定.