题目内容
12.下列有关表述正确的是( )(1)-OH与
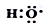 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同(2)次氛酸的电子式为:

(3)Mg2+的离子结构示意图:

(4)CO2的球棍模型示意图:

(5)熔化时NaHSO4的电离方程式为NaHSO4=Na++HSO4.
| A. | (1)(2) | B. | (3)(5) | C. | (4)(5) | D. | (1)(5) |
分析 (1)-OH与 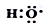 分别为羟基结构简式与电子式;
分别为羟基结构简式与电子式;
(2)次氯酸结构式为H-O-Cl,据此判断;
(3)镁离子最外层8个电子;
(4)二氧化碳为直线型分子;
(5)硫酸氢钠熔融状态下完全 电离生成钠离子与硫酸氢根离子.
解答 解:(1)-OH与 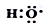 分别为羟基结构简式与电子式,组成元素相同,含有的电子数也相同,故正确;
分别为羟基结构简式与电子式,组成元素相同,含有的电子数也相同,故正确;
(2)次氯酸结构式为H-O-Cl,氧原子与氢原子、氯原子各共用1对电子,电子式为: ,故错误;
,故错误;
(3)镁离子最外层8个电子,离子结构示意图: ,故错误;
,故错误;
(4)二氧化碳为直线型分子,碳原子、氧原子在一条直线上,故错误;
(5)硫酸氢钠熔融状态下完全 电离生成钠离子与硫酸氢根离子,电离方程式:NaHSO4=Na++HSO4.故正确;
故选:D.
点评 本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写,考查全面,注重基础,题目难度较易.

练习册系列答案
相关题目
2.下列关于如图所示电化学装置的分析正确的是( )


| A. | 若X为直流电源,Y为铜棒接正极,则Fe棒上有铜析出 | |
| B. | 若X为直流电源,Y为碳棒接负极,则Fe棒被保护 | |
| C. | 若X为电流计,Y为锌棒,则SO42-移向Fe棒 | |
| D. | 若X为导线,Y为铜棒,则Fe棒发生还原反应 |
3.将SO2通入BaCl2溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀.则右侧Y形管中放置的药品组合不符合要求的是(必要时可以加热)( )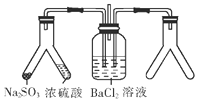

| A. | 大理石和稀盐酸 | B. | CaO和浓氨水 | C. | Cu和浓硝酸 | D. | MnO2和双氧水 |
17.某离子反应涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中c(NH4+)随反应进行逐渐减小.下列判断错误的是( )
| A. | 反应的氧化剂是ClO- | |
| B. | 反应生成l mol氧化产物时,转移的电子为6 mol | |
| C. | 氧化剂与还原剂的物质的量之比为2:3 | |
| D. | 反应后溶液的酸性明显增强 |
4.下列操作中正确的是( )
| A. |  加热液体 | B. |  加入固体粉末 | C. |  倾倒液体 | D. |  尾气吸收 |
2. 在容积一定温度一定的密闭容器中发生反应M2(?)+2R2(g)?M2R4(g),加入1mol M2和2molR2,反应过程中测得气体的平均相对分子质量随时间的变化如图所示.则下列说法错误的是( )
在容积一定温度一定的密闭容器中发生反应M2(?)+2R2(g)?M2R4(g),加入1mol M2和2molR2,反应过程中测得气体的平均相对分子质量随时间的变化如图所示.则下列说法错误的是( )
 在容积一定温度一定的密闭容器中发生反应M2(?)+2R2(g)?M2R4(g),加入1mol M2和2molR2,反应过程中测得气体的平均相对分子质量随时间的变化如图所示.则下列说法错误的是( )
在容积一定温度一定的密闭容器中发生反应M2(?)+2R2(g)?M2R4(g),加入1mol M2和2molR2,反应过程中测得气体的平均相对分子质量随时间的变化如图所示.则下列说法错误的是( )| A. | M2既可能为固体,也可能为气体 | |
| B. | 达到平衡后,保持容器容枳和温度不变,再加入1molM2和2molR2,则R2转化率不变 | |
| C. | 达到平衡后,保持温度不变,将容器容积压缩到原来的一半,当达到新的平衡时,R2的浓度可能是原平衡时的1.8倍 | |
| D. | 若M2为气体,达到平衡后,保持容器容积和温度不变,再加入1molM2R4,则新的平衡时气体的平均相对分子质量增大 |
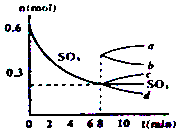 在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g);△H>0,其中SO3的变化如图所示:
在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g);△H>0,其中SO3的变化如图所示: