题目内容
7.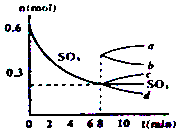 在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g);△H>0,其中SO3的变化如图所示:
在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g);△H>0,其中SO3的变化如图所示:(1)用O2表示0~8min内该反应的平均速率v=0.0125 mol/(L•min).
(2)升高温度,K值将增大;容器中气体的平均相对分子质量将减小.(填“增大”“减小”或“不变”)
(3)能说明该反应已达到平衡状态的是bc
a.v(SO3)=2v(O2) b.容器内压强保持不变
c.v逆(SO2)=2v正(O2) d.容器内密度保持不变
(4)从8min起,压缩容器为1L,则SO3的变化曲线为a
A. a B. b C. c D. d.
分析 (1)由图可知,0~8min内SO3减少0.6mol-0.2mol=0.4mol,v(SO3)=$\frac{\frac{0.4mol}{2L}}{8min}$=0.025 mol/(L•min),结合速率之比等于化学计量数之比计算用O2表示0~8min内该反应的平均速率v;
(2)该反应为吸热反应,升高温度,平衡正向移动,气体的质量不变,气体的总物质的量增大;
(3)结合平衡的特征“等、定”及衍生的物理量判定;
(4)从8min起,压缩容器为1L,瞬间三氧化硫的量增大,平衡逆向移动,三氧化硫的量继续增大,但小于0.6mol.
解答 解:(1)由图可知,0~8min内SO3减少0.6mol-0.2mol=0.4mol,v(SO3)=$\frac{\frac{0.4mol}{2L}}{8min}$=0.025 mol/(L•min),结合速率之比等于化学计量数之比计算用O2表示0~8min内该反应的平均速率v=0.025 mol/(L•min)×$\frac{1}{2}$=0.0125 mol/(L•min),故答案为:0.0125 mol/(L•min);
(2)该反应为吸热反应,升高温度,平衡正向移动,K增大;平衡正向移动,气体的质量不变,气体的总物质的量增大,则容器中气体的平均相对分子质量将减小,
故答案为:增大;减小;
(3)a.v(SO3)=2v(O2),不能确定正逆反应速率的关系,不能判定平衡,故不选;
b.该反应为前后气体体积不等的反应,则容器内压强保持不变,达到平衡状态,故选;
c.v逆(SO2)=2v正(O2),可知正逆反应速率相等,为平衡状态,故选;
d.质量、体积不变,则容器内密度始终保持不变,不能判定平衡,故不选;
故答案为:b c;
(4)从8min起,压缩容器为1L,瞬间三氧化硫的量增大,平衡逆向移动,三氧化硫的量继续增大,但小于0.6mol,只有a符合,故答案为:a.
点评 本题考查化学平衡的计算,为高频考点,把握图中物质的量变化、速率计算及平衡判定、平衡移动为解答的关键,侧重分析与应用能力的考查,注意图象与平衡移动原理的结合,题目难度不大.

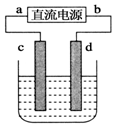 如图,电解质溶液是NaCl的水溶液,过一段时间发现d极附近有黄绿色气体产生,(c、d均为石墨电极)以下说法正确的是( )
如图,电解质溶液是NaCl的水溶液,过一段时间发现d极附近有黄绿色气体产生,(c、d均为石墨电极)以下说法正确的是( )| A. | a是电源的正极 | B. | 电子流动的方向:d→b | ||
| C. | c极发生氧化反应 |
| A. | 灼烧,看火焰是否为黄色 | B. | 滴加盐酸,看是否有气体产生 | ||
| C. | 溶解后测定溶液是否为碱性 | D. | 加热,看是否有气体生成 |
| 实验编号 | c(HA)/mol•L-1 | c(NaOH)/mol•L-1 | 混合溶液的pH |
| I | 0.2 | 0.2 | pH=a |
| II | c1 | 0.2 | pH=7 |
| III | 0.2 | 0.1 | pH>7 |
| IV | 0.1 | 0.1 | pH=9 |
①不考虑其它组实验结果,单从I组实验情况分析,若a=7(填“>”“<”或“=”),则HA为强酸.
②在II组实验的混合溶液中,c(A-)= c(Na+)(填“>”“<”或“=”).
③不考虑其它组实验结果,单从III组实验情况分析,HA是弱酸(填“强”或“弱”);用离子方程式表示混合溶液中存在的两种平衡:HA?H++A-,A-+H2O?HA+OH-.
④IV组实验的混合溶液中,由水电离出的c (OH-)=10-5 mol/L.
(1)-OH与
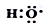 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同(2)次氛酸的电子式为:

(3)Mg2+的离子结构示意图:

(4)CO2的球棍模型示意图:

(5)熔化时NaHSO4的电离方程式为NaHSO4=Na++HSO4.
| A. | (1)(2) | B. | (3)(5) | C. | (4)(5) | D. | (1)(5) |
| A. | 升高体系的温度或增加某一组分的浓度均能增加反应体系中活化分子所占百分数 | |
| B. | H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl反应中化学能只转变为热能 | |
| C. | 面粉生产工厂要求严禁烟火是因为面粉有机物颗粒极小,总表面积巨大容易被引燃爆炸 | |
| D. | 高锰酸钾受热分解是一个熵减小的过程 |