题目内容
3.将SO2通入BaCl2溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀.则右侧Y形管中放置的药品组合不符合要求的是(必要时可以加热)( )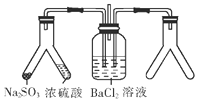
| A. | 大理石和稀盐酸 | B. | CaO和浓氨水 | C. | Cu和浓硝酸 | D. | MnO2和双氧水 |
分析 SO2与BaCl2不反应,而通入另一种气体后可以产生白色沉淀,则溶液中必须存在大量的SO32-或SO42-,右侧Y型管中应能生成碱性气体或氧化性气体,如是碱性气体,溶液中存在大量的SO32-,如是氧化性气体,溶液中可生成SO42-,则生成的沉淀可能为BaSO3或BaSO4,以此来解答.
解答 解:由图可知,右侧Y型管中应能生成碱性气体或氧化性气体,如是碱性气体,溶液中存在大量的SO32-,如是氧化性气体,溶液中可生成SO42-,则生成的沉淀可能为BaSO3或BaSO4,
A.反应生成二氧化碳,与氯化钡溶液也不反应,不能生成沉淀,故A选;
B.CaO和浓氨水生成氨气,通入氯化钡溶液和二氧化硫反应生成亚硫酸盐,会生成亚硫酸钡沉淀,故B不选;
C.Cu和浓硝酸反应生成二氧化氮具有强氧化性会氧化二氧化硫为硫酸,与氯化钡溶液反应生成硫酸钡沉淀,故C不选;
D.MnO2和双氧水反应生成氧气,二氧化硫、氧气、氯化钡反应生成硫酸钡沉淀,故D不选;
故选A.
点评 本题考查实验装置的综合应用,为高频考点,把握生成硫酸钡或亚硫酸钡沉淀时Y中提供气体的性质为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案
相关题目
13.工业上以碳酸锰矿为主要原料生产MnO2的工艺流程如图所示:
有关氢氧化物开始沉淀和沉淀完全的pH如下表;
请回答下列问题:
(1)酸浸前将碳酸锰矿粉碎的作用是增大接触面积,加快反应速率(使反应更充分).
(2)酸浸后溶液中含有Mn2+、SO42-,另含有少量Fe2+、Fe3+、Al3+、Pb2+、Cu2+等,其除杂过程如下:
①加入MnO2的目的是氧化亚铁离子得到铁离子;
②加入CaO将溶液调至pH=5.2~6,所得沉淀的成分为Fe(OH)3、Al(OH)3(填化学式);
③加入BaS除去Cu2+、Pb2+(填化学式)后,再加入NaF除去Ca2+.
(3)已知Ksp(CaF2)=4.0×10-11,计算当溶液中Ca2+完全沉淀[c(Ca2+)<10-5mol/L]后,所得
溶液每m3中至少含F-的质量为38g.
(4)从溶液A中回收的主要物质常用作化肥,该物质水解的离子方程式为NH4++H2O?NH3.H2O+H+.
(5)NH4HCO3溶液中,下列关系式正确的是AC.
A.c(NH4+)+c(NH3•H2O)=c(HCO3-)+c(CO32-)+c(H2CO3)
B.c(NH4+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
C.c(OH-)+c(NH3•H2O)=c(H+)+c(H2CO3)-c(CO32-)
D.(NH4+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)

有关氢氧化物开始沉淀和沉淀完全的pH如下表;
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 5.4 | 8.3 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 9.8 |
(1)酸浸前将碳酸锰矿粉碎的作用是增大接触面积,加快反应速率(使反应更充分).
(2)酸浸后溶液中含有Mn2+、SO42-,另含有少量Fe2+、Fe3+、Al3+、Pb2+、Cu2+等,其除杂过程如下:
①加入MnO2的目的是氧化亚铁离子得到铁离子;
②加入CaO将溶液调至pH=5.2~6,所得沉淀的成分为Fe(OH)3、Al(OH)3(填化学式);
③加入BaS除去Cu2+、Pb2+(填化学式)后,再加入NaF除去Ca2+.
(3)已知Ksp(CaF2)=4.0×10-11,计算当溶液中Ca2+完全沉淀[c(Ca2+)<10-5mol/L]后,所得
溶液每m3中至少含F-的质量为38g.
(4)从溶液A中回收的主要物质常用作化肥,该物质水解的离子方程式为NH4++H2O?NH3.H2O+H+.
(5)NH4HCO3溶液中,下列关系式正确的是AC.
A.c(NH4+)+c(NH3•H2O)=c(HCO3-)+c(CO32-)+c(H2CO3)
B.c(NH4+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
C.c(OH-)+c(NH3•H2O)=c(H+)+c(H2CO3)-c(CO32-)
D.(NH4+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
18.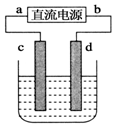 如图,电解质溶液是NaCl的水溶液,过一段时间发现d极附近有黄绿色气体产生,(c、d均为石墨电极)以下说法正确的是( )
如图,电解质溶液是NaCl的水溶液,过一段时间发现d极附近有黄绿色气体产生,(c、d均为石墨电极)以下说法正确的是( )
 如图,电解质溶液是NaCl的水溶液,过一段时间发现d极附近有黄绿色气体产生,(c、d均为石墨电极)以下说法正确的是( )
如图,电解质溶液是NaCl的水溶液,过一段时间发现d极附近有黄绿色气体产生,(c、d均为石墨电极)以下说法正确的是( )| A. | a是电源的正极 | B. | 电子流动的方向:d→b | ||
| C. | c极发生氧化反应 |
15.检验烧碱中是否混有纯碱的方法是( )
| A. | 灼烧,看火焰是否为黄色 | B. | 滴加盐酸,看是否有气体产生 | ||
| C. | 溶解后测定溶液是否为碱性 | D. | 加热,看是否有气体生成 |
12.下列有关表述正确的是( )
(1)-OH与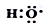 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同
(2)次氛酸的电子式为:
(3)Mg2+的离子结构示意图:
(4)CO2的球棍模型示意图:
(5)熔化时NaHSO4的电离方程式为NaHSO4=Na++HSO4.
(1)-OH与
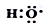 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同(2)次氛酸的电子式为:

(3)Mg2+的离子结构示意图:

(4)CO2的球棍模型示意图:

(5)熔化时NaHSO4的电离方程式为NaHSO4=Na++HSO4.
| A. | (1)(2) | B. | (3)(5) | C. | (4)(5) | D. | (1)(5) |
 (1)在一次化学晚会上,一位同学表演了一个有趣的魔术:用蘸有饱和硫酸铜溶液的玻璃棒在一洁净的铁片上点上数处,所点之处,点铁成“金”.你知道其中的奥妙吗?请用化学方程式表示其反应原理Fe+CuSO4=Cu+FeSO4 .若根据上述反应设计成原电池,请在方框中画出原电池的装置图,标出正、负极和电解质溶液,并写出正负极电极反应式.
(1)在一次化学晚会上,一位同学表演了一个有趣的魔术:用蘸有饱和硫酸铜溶液的玻璃棒在一洁净的铁片上点上数处,所点之处,点铁成“金”.你知道其中的奥妙吗?请用化学方程式表示其反应原理Fe+CuSO4=Cu+FeSO4 .若根据上述反应设计成原电池,请在方框中画出原电池的装置图,标出正、负极和电解质溶液,并写出正负极电极反应式.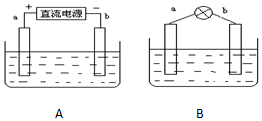 采用如下方法制作碱性氢氧燃料电池.如图A所示:a,b均为多孔石墨棒,其电解质溶液为NaOH,由于使用多孔石墨棒,此时生成的气体中有一部分被石墨棒吸附.然后如图B所示,移走直流电源,在a,b极间连接一个小灯炮,可以看到灯泡发光.请问:
采用如下方法制作碱性氢氧燃料电池.如图A所示:a,b均为多孔石墨棒,其电解质溶液为NaOH,由于使用多孔石墨棒,此时生成的气体中有一部分被石墨棒吸附.然后如图B所示,移走直流电源,在a,b极间连接一个小灯炮,可以看到灯泡发光.请问: